[ESMO 2022] 진행성 간세포암 1차 도전 임상3상 LEAP-002 연구 결과 공개
렌비마 단독요법 대비 OS, PFS 개선 입증 실패

[메디칼업저버 양영구 기자] 티쎈트릭(성분명 아테졸리주맙)과 아바스틴(베바시주맙) 조합이 진행성 간세포암(HCC) 1차 치료제로서의 위치를 공고히했다.
핵심 경쟁자로 여겨졌던 렌비마(렌바티닙)+키트루다(펨브롤리주맙) 조합이 HCC 1차 치료제로서의 기회를 타진했지만, 실패로 돌아갔기 때문이다.
이 같은 내용을 담은 임상3상 LEAP-002 연구 결과는 9~13일 프랑스 파리에서 열리는 유럽종양학회 연례학술대회(ESMO 2022)에서 공개됐다.
HCC 1차 치료, '티쎈+아바'
지난해 티쎈트릭+아바스틴 벙용요법은 2005년 넥사바(소라페닙) 등장 이후 HCC 환자를 위한 1차 면역요법 치료옵션으로 이름을 올렸다.
근거는 임상3상 IMbrave150 연구다. 이 연구에서 티쎈트릭+아바스틴 병용요법은 넥사바 대비 HCC 환자의 전체생존(OS)과 무진행생존(PFS)를 개선한 바 있다.
연구 결과, 티쎈트릭+아바스틴 병용요법은 넥사바 대비 사망 위험을 42% 감소시켰고(95% CI 0.42~0.79; p<0.001), 특히 질병 진행 및 사망 위험은 41% 개선됐다(95% CI 0.47~0.76; p<0.001).
아울러 PFS 중앙값은 6.8개월로, 넥사바 투여군 4.3개월보다 2.5개월 연장시키면서 1차 목표점을 충족했다. 또 OS는 데이터 컷오프 시점까지 중앙값에 도달하지 않은 반면, 넥사바 투여군은 13.2개월(중앙값)로 집계됐다.
당시 미국임상종양학회(ASCO)는 간세포암 치료 가이드라인을 개정하며 "가이드라인의 하이라이트는 HCC 1차 치료를 위한 티쎈트릭+아바스틴 조합에 대한 권장"이라며 "이 조합은 HCC 분야에서 승인된 최초의 면역요법 조합이다"고 강조하기도 했다.
1차 라인 도전 렌비마+키트루다, '실패'
이번 학회에서는 렌비마+키트루다 조합이 HCC 1차 치료제로 이름을 올릴 수 있을지 관심이 모였지만, 실패로 돌아갔다.
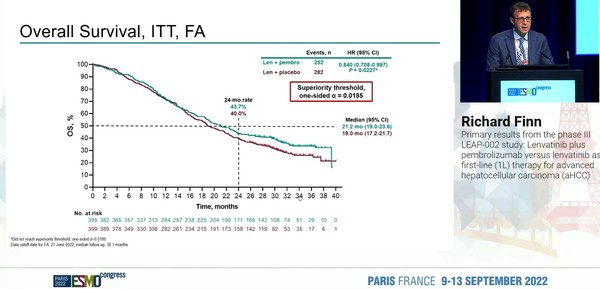
미국 캘리포니아대학 Richard Finn 교수 연구팀은 HCC 1차 치료로 렌비마+키트루다 조합을 평가한 임상3상 LEAP-002 연구 결과를 공개했다.
연구 결과부터 이야기하면 렌비마+키트루다 조합은 HCC 환자의 OS와 PFS를 통계적으로 유의하게 개선하지 못했다.
연구에는 HCC 환자 794명이 렌비마+키트루다 투여군(395명)과 렌비마+위약군(399명)에 1:1 무작위 배정됐다.
1차 목표점은 OS와 PFS로, 주요 2차 목표점은 객관적반응률(ORR)로 설정됐다.
32.1개월(중앙값) 추적관찰 결과, 렌비마+키트루다 투여군의 OS 중앙값은 21.1개월로, 렌미바+위약군 19개월에 비해 큰 차이가 없었다(HR 0.840; 95% CI 0.708~0.997; p=0.0227). 또 PFS 중앙값 역시 각각 8.2개월, 8개월로 차이를 보이지 않았다(HR 0.861; 95% CI 6.4~8.4; p=0.0466).
다만, 주요 2차 목표점인 ORR은 렌비마+키트루다 투여군이 62.5%로, 렌비마+위약군 17.5%보다 다소 높게 집계됐다.
3~5등급 치료관련 이상반응은 렌비마+키트루다 투여군이 62.5%, 렌미바+위약군이 57.5%로 집계됐다. 이 중 5등급 이상반응은 각각 1%, 0.8%였다.
연구팀은 "이번 연구에서 렌비마와 키트루다 조합은 HCC 환자의 OS와 PFS 개선에 실패하면서 1차 목표점을 충족하지 못했다"고 설명했다.
관련기사
- 적응증 확대 키트루다, 간세포암·전립선암서 '연속 실패'
- 간세포암 1차 전신치료에 면역관문억제제 전면에 등장
- "티쎈+아바 병용, 간암 치료 패러다임 바꿀 것"
- 백금 화학요법 부적합 NSCLC 1차 치료에 '티쎈트릭' 무게 실려
- 티쎈+아바 이상반응이 간세포암 치료 예측인자?
- 티쎈트릭, '간암'서 또 진전...초기치료 '완전정복' 노리나
- 연구 실패 거듭하는 키트루다, 전립선암·폐암도 '실패'
- 키트루다+렌비마, 흑색종·직장암 연구 중단
- 티쎈+아바 조합, 초기 간세포암 수술 후 보조요법 접수?
- 암 백신, 확실한 무기 없는 진행성 간세포암 2차 치료옵션 될까?
- 키트루다+렌비마 '또' 연구 실패, 자궁내막암 1차 진입 무산
- 티쎈+아바 실패 간세포암, '렌비마'가 대안되나
- 갈팡질팡 간세포암 티쎈+아바 이후 2차 치료옵션 정립되나

