전 세계 170여개 국가에 총 4억 9679만명분 수출
코로나19 등 감염병 진단기범도 국제표준으로 제정

[메디칼업저버 정윤식 기자] K-방역의 성과 즉, 신규 시장으로 창출된 코로나19(COVID-19) 진단시약이 11월 기준 약 2조 5000억원의 수출을 달성했다.
전 세계 170여개 국가에 약 4억 9000만명분이 수출됐으며 감염병 진단검사기법도 국제표준으로 제정됐다.
이는 식품의약품안전처와 관세청이 최근 공개한 코로나19 진단시약 허가와 수출현황 등을 통해 확인됐다.
식약처는 현재까지(12월 3일 기준) 국내 코로나19 진단 등을 위해 총 9개(유전자 7개, 항원 1개, 항체 1개) 제품을 정식허가 했다.
유전자 진단시약은 코로나19 감염자 확진을 위한 제품(6개)과 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자를 동시에 진단할 수 있는 제품(1개)으로 나뉜다.
아울러 유전자 진단에 비해 정확도는 부족하지만 신속하게 바이러스 유무를 확인할 수 있는 항원 진단시약 1개와 코로나19 바이러스에 대한 항체 존재여부를 확인 할 수 있는 항체 진단시약 1개가 있다.
추가적으로 정식허가를 신청한 진단시약도 존재한다.
유전자 진단시약 18개, 항원 진단시약 7개, 항체 진단시약 15개로 총 40개 제품이 심사 중에 있는 것이다.
국내 방역에 사용 중인 코로나19 진단시약의 1일 최대 생산량은 약 59만명분이고, 현재까지 558만명분을 생산해 이중 475만명분을 공급했다(총 313만건 검사).
현재 확보된 재고 약 83만명분은 최근 일주일 동안 1일 평균 검사량 2만명분을 감안했 때 약 한달 이상 의료현장에 공급할 수 있는 물량으로 안정적인 수급을 이어갈 수 있다는 게 식약처의 설명이다.
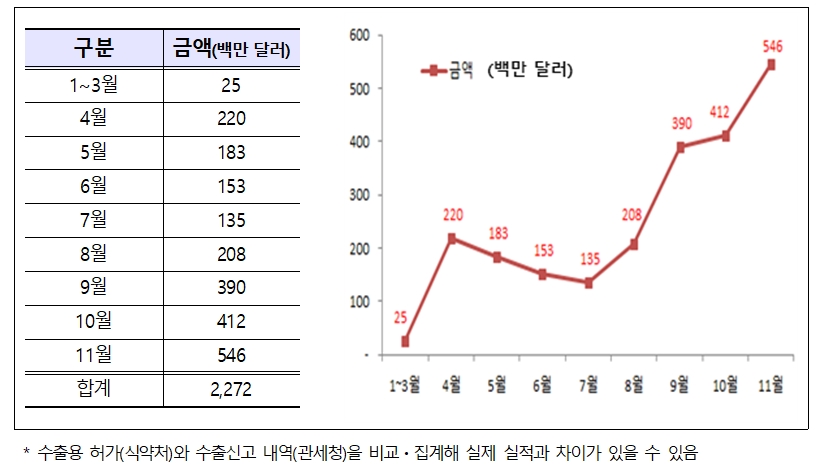
수출용 코로나19 진단시약은 현재 221개 제품(유전자 105, 항원 44, 항체 72)이 허가돼 전 세계 170여개 국가로 총 4억 9679만명분이 수출(11월 30일 기준)됐다.
관세청은 올해 초부터 11월까지 총 수출금액이 약 2조 5000억원(22억 7000만달러)으로 급증했다고 밝혔다.
4월부터 본격적으로 시작된 수출은 7월 이후 확진자 급증에 따라 가파른 상승세를 보였고 10월과 11월에 연이어 수출 최고치를 경신한 바 있다.
수출 국가별로 보면 인도(15.6%), 독일(13.2%), 네덜란드(9.6%), 이탈리아(7.8%), 미국(5.2%) 등으로 상위 5개 국가가 전체 수출액의 50% 이상을 차지하고 있다.
수출 국가도 1~3월 83개 국가에서 11월까지 총 170여개 국가로 지속적으로 확대됐다.
식약처는 이러한 코로나19 진단시약 수출실적이 올해 새롭게 창출된 수출 성과로서, 국제적으로 팬데믹 대응의 모범으로 인정받은 K-방역에 대한 인식과 우수한 인프라를 통해 개발된 국내 제품의 우수성이 함께 작용한 것으로 평가했다.
특히 우리나라가 제안한 코로나19 등 감염병 진단기법이 국제표준화기구(ISO)의 국제 표준(International Standard)으로 지난 2일 제정된 상태다.
코로나19 등 감염병 진단기법의 국제표준명의 국문명은 '체외진단 시험 시스템, 미생물 병원체의 검출 및 식별을 위한 핵산증폭기반 체외진단 검사 절차-검사실 품질적용 가이드(ISO 17822)'이고 영문명은 'In vitro diagnostic test systems, Nucleic acid amplification-based examination procedures for detection and identification of microbial pathogens-Laboratory quality practice guide(ISO 17822)'이다.
이번 국제표준 제정은 신종플루(2009년), 메르스(2015년) 등 신종 감염병이 잇따라 유행하면서 감염병 진단 검사 관련 절차와 방법에 대한 표준화 필요성이 국내·외에서 제기되는 가운데 우리나라에서 적극 추진됐다.
이번에 제정된 국제표준은 '유전자 증폭방식'의 체외진단검사를 수행하는 검사실의 운영절차 및 방법을 정의한 것이다.
코로나19 진단키트에 적용된 실시간 유전자 증폭기법(Real Time Polymerase Chain Reaction) 등 다양한 감염병 진단검사에 적용할 수 있는 표준을 의미한다.
특히, 유전자증폭방식 검사결과는 작업 과정의 작은 차이에도 영향을 받을 수 있어 이번 국제표준 제정이 코로나19 등 감염병 진단검사의 정확도 향상에 기여할 것으로 전망된다.
식약처 관계자는 "향후 국내 진단시약의 국제 신뢰도가 한층 향상되고 국산 체외진단의료기기의 해외시장 확대에도 추진력을 받을 것으로 기대한다"고 말했다.

