검사방식별 항원 1개, 항체 1개 제품 해당…현재 총 5개 업체 7개 제품 허가
[메디칼업저버 정윤식 기자] 식품의약품안전처가 최근 코로나19(COVID-19) 면역 진단시약 2개(항원, 항체 각 1개씩) 제품을 국내에 정식 허가했다.
이번에 허가한 코로나19 면역 진단시약 중 항원 진단시약은 의료인 또는 검사전문가가 사용하는 제품으로, 기존 유전자 진단 방식에 비해 정확도는 부족하지만 신속하게 결과를 확인할 수 있다.
이 제품은 검체(비인두 도말)로부터 코로나19 바이러스의 특정 성분을 검출해 바이러스 감염 여부를 확인하는 방식으로, 30분 내에 검사가 가능하다.
증상이 있는 사람에게만 사용해야 하며, 유전자 진단시약 검사 결과와 임상증상 등을 고려해 의사가 감염 여부를 최종 판단하도록 허가했다.
항원 진단시약의 허가는 대규모 확산 및 감염자 폭증 등의 감염 확산 상황에 따라 활용할 수 있는 검사방법 선택의 폭을 넓혔다는 데 의미가 있다는 게 식약처의 설명이다.
이어 항체 진단시약은 검체(혈액)로부터 항체를 분리해 이와 결합한 물질을 통해 코로나19 바이러스(SARS-CoV-2)에 대한 항체 존재 여부를 확인하는 방식이다.
이 제품은 15분 내외로 검사 시간이 짧고 과거 코로나19 바이러스 감염 이력을 확인할 수 있어 항체 생성 여부 확인 및 해외 입국 시 필요한 항체 검사결과 제출 등에 사용될 전망이다.
다만, 항체는 코로나19 바이러스에 대해 면역반응이 나타났다는 것만 확인되며 바이러스 존재 여부는 알 수 없어 감염 진단 목적으로 사용하는 것은 적합하지 않은 것으로 알려졌다.
즉, 항체 진단시약의 허가는 짧은 시간에 손쉽게 감염 이력 확인이 가능하다는 데 의미가 있다.
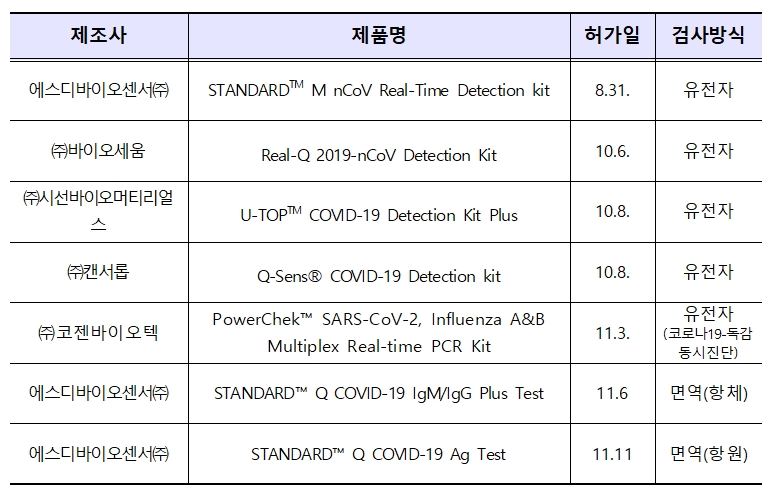
이번 2개 제품의 추가 허가로 식약처는 코로나19 유전자 진단시약 5개, 항원 진단시약 1개, 항체 진단시약 1개 등 총 5개 업체의 7개 제품을 허가한 상태다.
이 외에 11월 10일 기준 유전자 진단시약 14개, 항원 진단시약 4개, 항체 진단시약 11개 등 29개 제품이 국내 허가를 신청해 현재 심사 중에 있다.
식약처 관계자는 "국내·외 코로나19 진단시약의 개발 동향을 지속적으로 모니터링하고 있다"며 "품질이 우수한 제품의 개발을 적극적으로 지원하고 신속하게 허가해 우리 국민이 진단과 치료 기회를 보장받을 수 있도록 노력하겠다"고 말했다.

