4일부터 정식허가 제품만 사용 가능…정식허가 제품 12개
[메디칼업저버 정윤식 기자] 코로나19(COVID-19) 발생 초기에 검사 역량을 확보하는 데 이바지한 확진용 유전자진단시약 7개 제품의 긴급사용이 종료됐다.
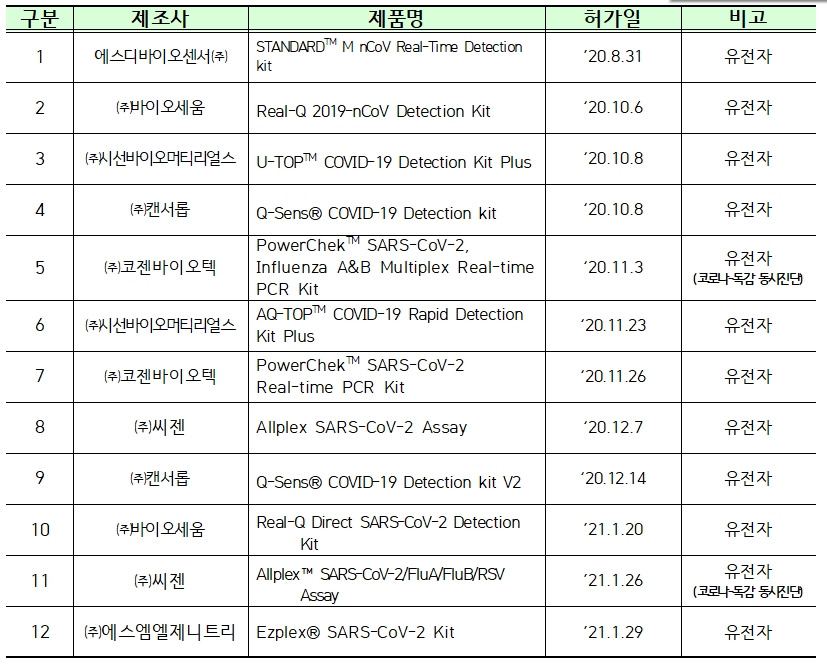
이에 4일부터는 정식으로 허가된 제품 12개를 통해서만 진단검사가 시행된다.
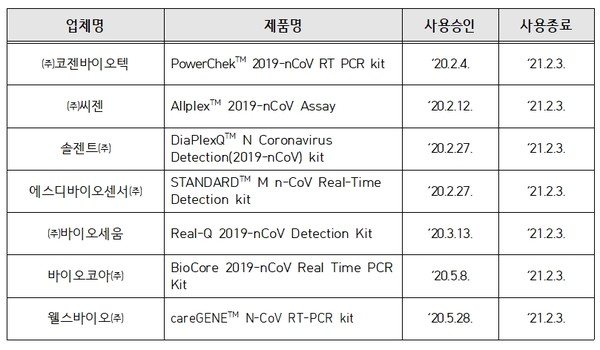
식품의약품안전처와 질병관리청은 코로나19 확진검사를 위해 지난해 2월부터 긴급사용 승인한 확진용 유전자진단시약 7개 제품에 대해 '의료기기법 시행령' 제13조의2에 따라 긴급사용을 종료한다고 밝혔다.
7개 제품은 코젠바이오텍, 씨젠, 솔젠트에스디바이오센터, 바이오세움, 바이오코아, 웰스바이오 등에서 생산하고 있었다.
이번 조치는 확진용 유전자진단시약의 허가현황, 생산량·공급량·재고량 등을 고려할 때 정식허가된 12개 제품이 긴급사용 제품을 충분히 대체할 수 있다는 판단에 따른 것입니다.
12개 제품은 에스디바이오센서, 바이오세움, 시선바이오머티리얼스, 캔서롭, 코젠바이오텍, 씨젠, 에스엠엘제니트리 등에서 생산하고 있다.
긴급사용은 '의료기기법 제46조의2'에 따라 감염병 대유행이 우려돼 긴급히 진단시약이 필요하지만 국내에 허가제품이 없는 경우, 중앙행정기관의 장(질병관리청 포함)이 요청한 제품을 한시적으로 제조(수입)·판매·사용할 수 있게 하는 특례제도다.
식약처와 질병청은 긴급사용 제품의 정식허가 전환을 위해 지난해 4월 24일부터 '코로나19 진단시약 신속허가 지원방안'을 마련해 단계별로 밀착지원을 했다.
질병청 관계자는 "현장에서 무리 없이 긴급사용을 종료하고 정식허가제품을 사용할 수 있도록 긴급사용 제조업체, 대한진단검사의학회 등과의 간담회를 통해 종료를 사전 안내해 왔다"고 말했다.
식약처는 관계자는 "코로나19 검사에 문제가 되지 않도록 진단시약의 공급과 현장모니터링 등을 지속적으로 실시하겠다"고 언급했다.
한편, 정식허가된 12개 제품의 1일 최대 생산량 약 64만명분은 긴급사용승인된 7개 제품의 1일 최대 생산량인 약 16.5만명분 보다 약 3.9배 많고, 1일 평균 검사건수 17.5만명분의 3.7배 수준이다.

