CKD-701 바이오시밀러 임상3상 동등성 입증 성공
식약처 허가 문턱만 남겨…글로벌 시장 4조원대 추산

[메디칼업저버 정윤식 기자] 종근당이 황반변성 치료제 루센티스(성분명 라니비주맙)가 차지하고 있는 연 370억원 시장에 도전장을 내밀 수 있을 것으로 보인다.
개발 중인 루센티스의 바이오시밀러 임상3상에 성공, 조만간 식품의약품안전처에 품목허가를 신청할 예정인 것으로 나타났다.
이는 종근당이 최근 금융감독원 전자공시시스템을 통해 공시한 '투자판단 관련 주요경영사항'을 통해 확인됐다.
이번 임상3상은 신생혈관성(습성) 연령 관련 황반변성 환자에서 'CKD-701'과 루센티스의 유효성, 안전성, 약동학적 특성, 면역원성을 비교 평가하기 위한 것이다.
다기관, 무작위배정, 이중눈가림, 활성대조, 평행설계 연구다.
대상자로부터 자발적인 문서동의를 받은 후 스크리닝 방문 시 선정·제외 기준을 평가했고, 무작위배정 후 임상약 투여를 시작했다.
대상자는 12개월의 치료기간 동안 첫 3개월은 한 달에 한 번씩 투여 받았고, 이후 9개월 동안은 사전에 설정된 투여 기준에 따라 필요시(pro re nata, PRN) 투여 받았다.
1차 유효성 평가변수는 기저치 대비 3개월 시점의 최대 교정시력(BCVA) 평균 변화로 설정했으며, 사전에 설정한 동등성 범위 충족 여부를 확인했다.
임상시험 결과, 1차 유효성 평가변수인 기저치 대비 3개월 시점의 최대 교정시력에서 15글자 미만의 시력 손실을 보인 환자의 비율은 CKD-701 투여군 97.95%(143/146명), 루센티스 투여군 98.62%(143/145명)로, 사전에 설정한 동등성 범위를 충족했다.
또한 △2차 유효성 평가변수인 기저치 대비 3·6·12개월 시점의 최대 교정시력 변화 △최대 교정 시력에서 15글자 이상의 시력 호전을 보인 환자의 비율 △중심망막두께(CRT) 변화 △기저치 대비 6·12개월 시점의 최대 교정시력에서 15글자 미만의 시력 손실을 보인 환자의 비율 △망막내액 또는 망막하액이 보이지 않는 환자의 비율에서도 루센티스와 유사한 치료 효과를 확인했다.
CKD-701 투여 시 보고된 대부분의 이상반응은 루센티스 이전 연구들에서 기 보고된 이상반응으로, 발현 경향성이 유사했다.
이상반응 발현율을 살펴보면 투여군간 유의한 차이는 확인되지 않았고 CKD-701은 루센티스와 유사한 약동학, 면역원성 프로파일을 확인했다.
루센티스 바이오시밀러 개발에 뛰어든 다른 업체로는 삼성바이오에피스 등을 들 수 있다.
하지만 삼성바이오에피스는 최근 SB11의 글로벌 임상시험을 끝내고 유럽과 미국에 허가를 신청해 심사가 진행 중이기 때문에, 현재 국내에서는 루센티스 바이오시밀러가 없는 상황과 마찬가지다.
이런 상황에서 종근당이 이번 임상3상에 성공하면서 국내 첫 허가 가능성이 높게 점쳐지고 있다.
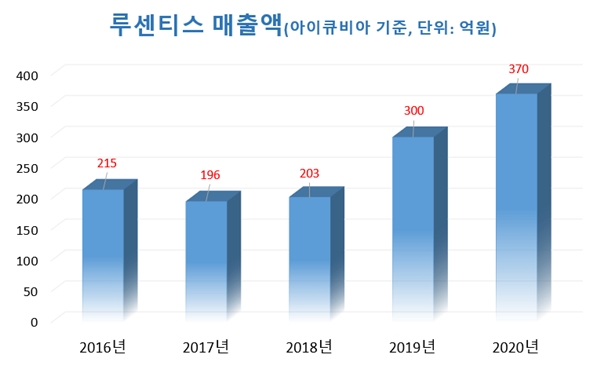
실제로 아이큐비아 기준 루센티스의 최근 5년 매출 현황을 집계하면 2016년 215억원, 2017년 196억원, 2018년 203억원으로 200억원대에 머물다 2019년을 기점으로300억원을 넘어서더니 2020년 370억원으로 급격히 성장했다.
특히, 지난해 글로벌 시장 매출은 약 4조 6000억원으로 추산된다.
이처럼 루센티스는 국내 시장뿐만 아니라 글로벌 시장에서도 성장 잠재력이 큰 만큼, 종근당은 이번 동등성 입증으로 치료 기회 확대와 약물 선택의 다양성을 기대하고 있다.
종근당 관계자는 "CKD-701은 이번 임상시험을 통해 신생혈관성(습성) 연령 관련 황반변성 환자에서 루센티스와 비교해 치료 효과가 동등함을 입증했고 유사한 안전성 및 면역원성 프로파일을 보였다"라고 설명했다.
이어 "루센티스의 동등생물의약품으로써 환자들에게 치료 약물 선택의 다양성을 제공하고 치료 기회 확대를 가져올 수 있을 것으로 사료된다"라고 덧붙였다.

