품질 평가 기준 설정 가이드라인 발간
전 세계적으로 아직 허가된 의약품 없어
[메디칼업저버 정윤식 기자] 식품의약품안전처가 첨단 기술을 적용한 '마이크로니들 의약품'의 제품화 지원에 나선다.
식약처는 마이크로니들 의약품의 규격설정 및 품질자료 작성 등 품질평가 기준 설정을 위한 가이드라인(민원인 안내서)을 제정한다고 25일 밝혔다.
마이크로니들 의약품이란 국소적 또는 전신적 효과를 위해 미세한 바늘을 이용해 주성분을 혈관이 아닌 피부를 통해 전달하는 방식의 의약품을 말한다.
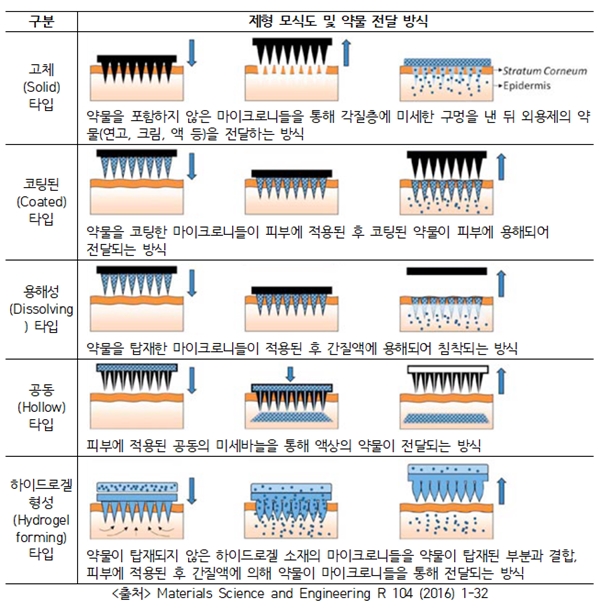
이번 가이드라인의 주요 내용은 △마이크로니들 타입별 분류 △품질 규격 설정 시 고려사항 △특성이나 기능 등을 설정하기 위한 제제학적 시험 항목 등이다.
마이크로니들 의약품은 통증이 매우 적어 투약 순응도가 높고 감염 사고를 예방할 수 있는 등의 장점으로 기존 주사제나 경구용 제제의 단점을 극복할 수 있는 제형으로 기대되고 있다.
마이크로니들 의약품의 전 세계 시장 규모(퓨처마켓인사이트 리포트 2020년판 기준)는 2015년 4억 7000만 달러(한화 5279억 원)에서 2019년에는 6억 2160만 달러(6916억 원)로 확대됐고, 2030년에는 12억 390만 달러(1조 3521억 원)에 이를 것으로 전망된다.
하지만 현재까지 전 세계적으로 허가된 마이크로니들 의약품은 없는 것으로 알려졌다.
단지 2019년 미국 식품의약국(FDA)에 편두통 치료제로 신약승인을 신청한 미국 '조사노파마' 사가 관련 개발에 가장 앞서 있으며, 국내에서는 골다공증과 치매 치료제가 임상1상을 진행하고 있다.
식약처는 이번 가이드라인이 국내 제약업체나 벤처기업의 임상시험 진입 등 마이크로니들 의약품 제품화에 도움을 줄 것으로 기대했다.
식약처 관계자는 "앞으로도 제약업계에서 필요로 하는 최신 정보를 반영해 가이드라인을 지속적으로 제·개정해 나가겠다"고 말했다.

