약물치료 받지 않는 7~12세 ADHD 소아 환자 치료기로 허가받아
[메디칼업저버 박선혜 기자] 주의력 결핍 및 과잉 행동 장애(ADHD) 비약물적 치료요법으로 뇌를 자극하는 치료기가 미국식품의약국(FDA) 첫 승인을 받았다.
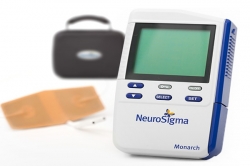
FDA는 19일(현지시간) ADHD 치료기인 모나크(Monarch) 외부 삼차신경 자극(external trigeminal nerve stimulation, eTNS) 시스템을 승인했다.
eTNS 시스템은 ADHD 약물치료를 받지 않는 7~12세 ADHD 소아 환자 치료기로 허가받았다.
치료기는 휴대폰 정도로 크기가 작으며 가정에서 환자가 수면하는 동안 보호자의 감독하에 사용 가능하다.
작은 패치를 눈썹 위 이마에 붙여 사용하며 전선을 통해 낮은 전기자극을 전달해 ADHD에 관여한다고 여겨지는 뇌 부위에 치료 신호를 준다. 전기자극에 따라 피부에서 따끔거림이 느껴져야 한다.
eTNS가 어떤 메커니즘으로 작용하는지는 아직 확실하지 않지만, 뇌영상 연구 결과에서 eTNS가 주의력, 감정, 행동을 조절하는 중요한 뇌 부위 활성을 증가시킨다고 보고된다.
중등도~중증 ADHD 소아 환자 62명을 eTNS 시스템 치료군 또는 위약군으로 무작위 분류해 치료 효과를 확인한 결과, 4주 치료 후 eTNS 시스템 치료군의 ADHD 평가척도가 등록 당시 대비 10.7점 감소해 위약군(6.2점 감소)보다 유의미하게 개선됐다.
eTNS 시스템의 주요 이상반응으로 졸림, 수면 어려움, 식욕 증가, 두통, 피로, 이갈이 등이 보고됐지만 심각한 이상반응은 없었다.
FDA의 Carlos Pena 박사는 "새로운 기기는 경도 신경자극으로 ADHD 소아 환자를 치료하는 안전한 비약물적 치료전략이다. ADHD 치료기가 승인받은 것은 이번이 최초"라며 "이번 승인에 따라 소아 환자는 혁신적이고 안전하며 효과적인 의료기기에 접근할 수 있다"고 강조했다.
다만 eTNS 시스템은 7세 미만 소아 환자 또는 능동형 이식형 조율기, 능동형 이식형 신경자극기, 인슐린 펌프 등 웨어러블 기기 등을 사용하는 환자에게는 활용할 수 없다.
뿐만 아니라 MRI, 휴대폰, 무선주파수 에너지를 가진 기기 근처에서 eTNS 시스템을 사용해선 안된다.
한편 eTNS 시스템은 ADHD뿐 아니라 삽화(episodic), 만성 편두통, 주요 우울장애, 뇌전증 등 치료에서도 긍정적인 결과를 얻은 바 있다.

