인디애나의대 소화기내과 Paul Y Kwo 교수 연구 결과
C형간염바이러스(HCV) 치료에서 경구용 바이러스직접작용제제(DAA)가 인터페론 기반의 병용치료에 비해 지속바이러스반응(SVR) 개선과 이상반응을 줄인 것은 분명하지만, 월등한 가격차이에는 고민이 따른다.
더욱이 인터페론 치료에 좋은 반응률을 나타내는 'IL-28B 유전자형 CC' 분포가 높은 한국인에서 굳이 값비싼 DAA만을 고집해야 하는가에 여전히 논쟁이 진행중이다.
이번 Liver Week 2014에서 다뤄진 C형간염 세션의 주된 이슈는 추후 도입 예정인 경구용 DAA의 비용효과 문제와 인터페론 제외 여부였다.
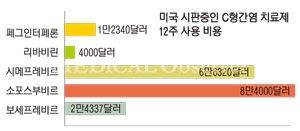
비용문제는 2014년 미국과 유럽간학회의 개정된 치료가이드라에서 표준치료가 소포스부비르와 시메프레비르, 다클라타스비르 등의 경구용 DAA로 전환되면서 불거졌다. 여기서 1차 치료제로 전면에 나선 DAA는 바이러스 작용부위에 따라 NS3/4A, NS5A, NS5B 등으로 구분.
이와 관련 인디애나의대 소화기내과 Paul Y Kwo 교수는 "HCV 치료, 인터페론-제외(free)요법 전환에 앞서 인터페론 병용 이대로 유용한가?"를 주제로 13일 Early Morning Breakfast 워크숍에서 그간의 연구들을 분석했다.
Kwo 교수에 따르면 국내 HCV 감염은 60세에서 유병률이 높고 유전자형의 분포는 1b형과 2형에서 주로 보고됐으며 1995~2000년까지 HCV 전체 유병률은 40세 이상에서 1.29% 수준(95% CI 1.12~1.48)으로 낮았다.
또 국내는 미국과 유럽지역에서 부작용 문제로 퇴출되다시피 빠진 1세대 DAA 텔라프레비르와 보세프레비르마저 도입이 안 된 상황으로, 아직 1차 치료제로 페그인터페론+리바비린 병용요법을 권고하고 있다.
Kwo 교수는 2009년 네이쳐에 발표된 Ge et al 연구결과를 들어 "직접비교연구는 아니지만 페그인터페론+리바비린의 24-48주 치료에 국내 환자들의 SVR 비율은 유전자형 1형 65%, 유전자형 2형 85%로 서구지역에 비해 높았다"며 국내서 시행하는 기존 인터페론 병용치료에 근거를 댔다.
한편 국내에도 DAA 도입이 머지않은 상황에서 인터페론을 기반으로 한 기존 치료 성적을 기준으로 기존 치료+DAA, DAA만을 사용한 병용요법의 연구 결과를 살펴본다.
△ DAA, 강점과 약점은 무엇?
먼저 NS3/4A 억제제(단백분해효소 억제제)는 보세프레비르, 텔라프레비르, ABT-450/r, 아수나프레비르, 시메프레비르, MK-5172 등이 포함되고 고강도 및 제한된 유전자형 적용범위, 낮은 내성장벽을 특징으로 한다. NS5A 억제제는 다클라타스비르, 레디파스비르, ABT-267 등으로 대표되고 고강도 및 다양한 유전자형 적용이 가능하며 낮은 내성장벽을 보인다.
이어 미국과 유럽에서 표준치료제로 널리 알려진 소포스부비르는 NS5B(뉴클레오사(타)이드 억제제)에 속하며 중등도 강도와 전반적인 유전자형 적용이 가능하고 높은 내성장벽을 지녔다. 반면 NS5B NN(비뉴클레오사이드 억제제)는 ABT-333 등이 해당돼 제한된 유전자형 적용 및 낮은 내성장벽에서 차이를 나타낸다.
여기서 Kwo 교수는 "앞서 언급한 단백분해효소 억제제인 보세프레비르 혹은 텔라프레비르를 추가해 병용한 그룹은 기존 페그인터페론+리바비린 치료보다 환자 SVR 개선과 재발에 있어 효과를 나타냈지만, 텔라프레비르는 발진 및 위장관계 부작용과 빈혈을, 보세프레비르는 빈혈과 미각장애가 관찰됐다"면서 "진행성 간섬유화증을 가진 환자에서는 주의깊은 모니터링이 요구되고 초 치료시 피부과 전문의 컨설트와 약물간 상호작용이 평가돼야 한다"고 설명했다.
새로 도입된 약제들의 부작용을 살펴보면 NS3 계열 DAA는 발진과 함께 수송체 억제작용으로 인한 빌리루빈 상승이 보고됐고, NS5A와 NS5B는 이상반응이 거의 관찰되지 않았다. 이는 리바비린이 빈혈, 인터페론이 독감유사증상(flu like symptom), 혈구감소증, 진행성 간질환에서 비대상성 증상을 보이는 것과 확연한 차이다.
게다가 미국과 유럽에서 HCV 표준치료제인 소포스부비르는 유전자형 1~6형까지 강력한 항바이러스 효과를 가지며 높은 내성장벽을 갖고 2000명 이상을 대상으로 한 임상에서 안전성과 내약성을 확보했다. 더욱이 음식물과 유의한 약물 상호작용은 관찰되지 않았다.
△ 인터페론 제외 DAA 병용요법, 효과와 이상반응에 '우월'
이전 치료경험이 없는 HCV 유전자형 1형 785명 환자를 대상으로 기존 페그인터페론+리바비린 치료에 단백분해효소 억제제 계열인 시메프레비르를 추가한 QUEST 1과 2 임상시험 결과 시메프레비르 150mg을 12주간 투여하고 페그인터페론+리바비린을 24주 혹은 48주 추가한 그룹에서 SVR24는 88% 수준으로 나타났다. 이상반응으로 인해 투약을 중단한 비율은 3%로 빌리루빈과 광독성이 증가했다.
이어 Kwo 교수는 "유전자형 1, 4, 5, 6형 환자를 대상으로 페그인터페론+리바비린에 소포스부비르를 추가해 효과를 평가한 NEUTRINO 연구 결과 327명의 환자 중 295명에서 SVR12 비율은 대개 90% 이상으로 관찰됐다"고 덧붙였다.
한편 인터페론-제외요법의 경우, 유전자형 2형 환자에서 소포스부비르+리바비린을 1차 치료제로 사용했을 때 치료경험과 간경화 유무를 포함한 전반적인 SVR12는 73명 중 68명이 93%로 나타났고, 유전자 3형은 소포스부비르+리바비린 치료에 250명 환자 중 212명이 평균 85%의 SVR24 비율을 보였다.
또 GS5816(25, 100mg)의 2개 용량을 사용한 소포스부비르(NS5b )+GS5816(NS5a) 치료 결과 유전자형 1, 2형에서 GS5816 100mg 병용군은 SVR12가 100%로 나타났고, 유전자형 3형은 25mg(GS5816)을 사용한 군과 같은 93%로 확인됐다.
연구에 대해 Kwo 교수는 "미국과 일부 유럽지역에서는 HCV 유전자형 1형 환자를 대상으로 올 연말까지 인터페론을 제외한 경구용 제제 조합이 표준치료로 확산될 것"이라고 강조했다. 이는 최근 동일 환자에서 ABT-450/r, 옴비타스비르, 다클라타스비르+/-리바비린을 사용했을 때 SVR12 비율이 473명의 환자 중 455명에서 평균 96.2%로 확인돼 힘을 싣고 있다.
이와 함께 유전자형 2,3형 환자를 대상으로 한 소포스부비르의 3상임상 분석결과 경구제제 병용군(소포스부비르+리바비린)과 인터페론 기반(페그인터페론+리바비린)치료의 비교에서 투약 24주후 경구제제 병용군에서는 이상반응으로 인한 투약중단이 1명(250명 중) 미만으로, 인터페론 기반치료군 11명(243명 중)과 비교해 우월성을 보였다(Gordon S, EASL, 2014, P1171).
끝으로 Kwo 교수는 HCV 유전자형 1b형 환자에서 페그인터페론 또는 리바비린을 제외한 경구용 DAA 치료전략을 최선으로 꼽았는데 이는 높은 내약성과 12주 치료 결과 SVR 비율이 95%를 넘어서는 결과를 보였고, 진행성 간섬유화증 환자에서도 SVR 비율이 높게 나왔다는 근거를 들었다.

