[ASCO GI23] 서울대병원 오도연 교수팀, ABL001 임상2상 공개
ORR은 37.5% DOR 9.4개월, PFS 9.4개월 기록
호중구감소증, 고혈압 등 치료 관련 부작용은 숙제로 남아

[메디칼업저버 박선재 기자] 진행성 담도암 환자에게 새로운 치료옵션이 등장할 것으로 보인다.
서울대병원 오도연 교수(종양내과) 연구팀이 CTX-009/파클리탁셀을 병용했을 때 객관적 반응률(ORR)과 전체생존율(OS)를 향상시킨다는 연구 결과를 발표했다.
이번 연구는 미국 샌프란시스코에서 1월 19~21일까지 열린 2023 ASCO Gastrointestinal Cancers Symposium에서 공개됐다.
ABL001(CTX-009)은 에이비엘바이오가 이중항체 플랫폼 기술을 활용해 개발한 항암제다. ABL001은 DLL4와 VEGFA를 동시에 표적하고, 종양미세환경에서 신생혈관 형성에 역할을 하는 것으로 알려졌다.

현재는 한독이 에이비엘바이오와 기술이전 계약을 맺고 국내 임상을 진행 중이다. 글로벌 판매권은 미국 컴패스테라퓨틱스가 갖고 있다.
이 연구는 오픈라벨 다기관 단일군 임상2상으로 국내 4개 병원에서 진행됐다.
연구에는 절제 불가능한 진행성, 전이성 또는 재발성 담도암 환자 중 이전에 1차 또는 2차 전신 항암치료를 받은 환자를 대상으로 진행됐다.
연구팀은 파클리탁셀+ABL001 병용 투여해 유효성과 안전성을 비교했다.
ABL001(10mg/kg)은 일주일에 두번 정맥으로 투여했고, 타클리탁셀(80mg/㎡ )은 4주마다 1, 8, 15일에 정맥투여했다.
1차 목표점은 반응평가기준(RECIST v1.1)을 기반으로 한 객관적반응률(ORR)이었다.
2차 목표점은 반응 기간(DOR), 무진행생존(PFS), 전체생존(OS), 치료 실패까지의 시간(TTF)과 안전성 등이었다.
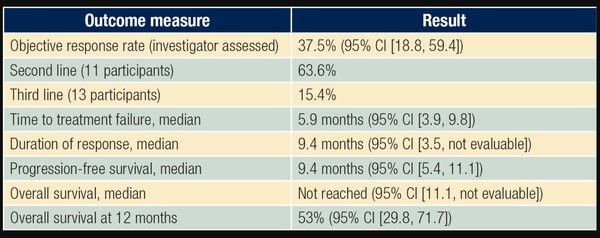
지난해 8월 데이터컷오프 시점까지의 분석 결과, 병용요법의 ORR은 37.5%로 확인됐다(95% CI: 18.8-59.4; 2차 치료: 63.6%, 3차 치료: 15.4%). 또 2차 치료를 받는 환자(11명)의 ORR은 63.6%, 3차(13명)는 15.4%였다.
2차 목표점인 DOR 중앙값은 9.4개월(95% CI: 3.5-NE), PFS 9.4개월(95% CI: 5.4-11.1), TTF는 5.9개월을 기록했다(95% CI: 3.9-9.8). OS는 측정 중이고, 12개월차 OS는 53%(95% CI: 29.8~71.7)였다.
오도연 교수는 "이번 연구의 핵심은 아직 많이 연구하지 않고 있는 담도암에서 항혈관신생 전략을 테스트한 것"이라며 "담도암에서 약물 개발을 위한 항혈관신생 전략은 더 탐구할 가치가 있지만 효능과 안전성 프로파일 균형도 고려해야 한다"고 말했다.
문제는 안전성이었다.
ABL001과 파클리탁셀 병용요법은 모든 등급 치료 관련 부작용(TRAE)이 100% 보고됐다. 특히 75% 환자에서 호중구감소증(50%), 고혈압(16.7%), 빈혈(12.5%) 및 혈소판감소증(8.3%) 등 3등급 이상의 부작용이 나타났다.
이에 대해 오 교수는 "우리는 바이오마커 기반 환자 선정을 하지는 못했지만, 전신 상태와 담도배액 상태 등을 고려하는 등 임상시험에 참여하는 환자를 선택할 때 매우 주의를 기울였다"며 "또 용량 수정, 환자 추적관찰 등에도 주의해야 했다"고 말했다.
연구팀은 이번 임상2상을 기반으로 ABL001 연구를 계속할 예정이고, 무작위대조군 연구도 계획하고 있다고 밝혔다.

