충남대·세브란스, 유전자가위기술 이용 질환모델동물 개발
희귀질환 치료제 개발 위한 성공적 중개연구 모델 제시
[메디칼업저버 정윤식 기자] 충남대와 세브란스병원 공동연구팀이 희귀유전질환 및 뇌 발달장애인 '소멸백질병(Vanishing White Matter Disease)'의 질환동물모델을 세계 최초로 개발하고 병리 기전을 규명해 치료의 첫걸음을 내디뎠다.
충남대 김철희 교수(생물과학과)와 세브란스병원 강훈철·김세희 교수(소아신경과) 공동연구팀은 이번 성과를 유전학 분야 학술지인 '인간분자유전학(Human Molecular Genetics)'에 최근 게재했다고 22일 밝혔다.
소멸백질병은 백질뇌증, 백질형성장애(백질이영양증) 중 하나로 'EIF2B3'로 불리는 유전자 돌연변이에 의해 중추신경백질이 서서히 파괴되는 질병이다.
흔히 동반되는 증상은 움직임 조절에 장애가 생기는 운동실조, 강직, 저긴장증, 경련 등이다.

특히 출생 후 1년 이내의 영아에게 발생하면 두 살이 되기 전 대부분 사망하는 치명적인 질병이지만 아직 정확한 발병기전 및 치료방법이 알려지지 않았다.
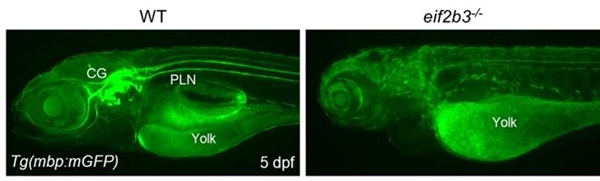
연구팀은 유전체 분석과 제브라피시, 유전자가위 기술을 사용해 소멸백질병의 동물모델을 개발했다.
이 동물모델을 통해 EIF2B3 유전자가 신경계 미엘린 생성(myelination) 초기 단계에 관여하고, 신경아교세포의 발생과 분화에도 영향을 끼친다는 것을 확인했다.
미엘린 구조는 뇌에서 신경세포를 보호하는 역할을 하는데, 정상적인 미엘린 구조가 있어야 뇌에서 정보를 전달하는 속도가 빨라지고 정보를 기억하고 논리적으로 생각하는 능력이 향상된다.
실험 결과, EIF2B3 유전자 결핍 동물모델은 그렇지 않은 동물모델에 비해 신경계 미엘린 생성 결핍 증상을 보였다.
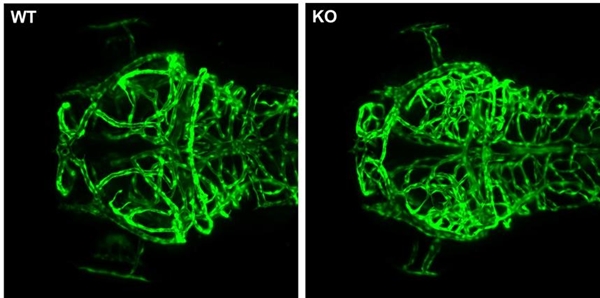
또한 소멸백질병 동물모델에서 혈관신생성장인자(VEGF) 발현이 증가하고, 병리적 신생혈관이 형성되는 것을 확인했다.
혈관신생성장인자 신호경로가 소멸백질병의 치료 표적이 될 수 있음을 밝혀낸 것이다.
공동연구팀은 "소멸백질병은 진단이 어렵고 치료법이 없는 희귀 신경질환"이라며 "치료제 개발이 시급하지만 병리 기전에 대한 이해가 부족해 초기 후보물질 선정 및 임상시험 진행이 어렵다"라고 강조했다.
이어 "이번 연구는 임상의학과 기초과학의 공동연구를 통해 소멸백질병의 병리기전을 밝히고 치료표적을 제시한 연구"라며 "희귀질환 치료제 개발을 위한 성공적인 중개연구 모델을 제시했다"라고 덧붙였다.
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업 연구소재지원사업(질환모델링제브라피쉬은행)의 지원을 통해 진행됐다.

