심평원, 다제내성 결핵신약 사전심사제 Q&A 공개…최대 24주까지 유효
서튜러, 델티바와 같은 다제내성 결핵신약을 이미 복용 중인 환자는 사전심사에서 제외된다.

건강보험심사평가원은 1일 이 같은 내용의 ‘다제내성 결핵신약 사전심사제’ 관련 Q&A를 공개했다.
앞서 정부는 다제내성 결핵신약에 대해 내성균 발생을 방지할 수 있도록 사전심사제를 통해 투약 관리를 해나가기로 결정한 바 있다.
이에 따라 9월부터 다제내성 결핵신약을 사용하고자 하는 의료기관은 질병관리본부에 사전심사를 신청해야 하며, 질병관리본부 심의위원회 및 심평원 심사를 거쳐 최종 승인받은 후 약제 사용이 가능하다.
하지만 사전심사제 시행 이전에 급여를 인정받아 서튜러, 델티바와 같은 다제내성 결핵신약을 복용 중인 환자는 사전심사를 추가로 받을 필요가 없다.
심평원은 “기존에 급여를 인정받아 24주 이내로 다제내성 결핵신약을 복용하고 있던 환자는 사전심사가 필요하지 않다”고 밝혔다.
다만, 사전심사제가 시행되는 이번달부터는 보험청구 시 사전심사제 시행 이전 급여인정건은 청구명세서 특정내역(MX999, JX999)DP “기 심사인정된 건으로 24주 기간이내 투여건” 등을 반드시 적어야 한다.
하지만 24주 이내 치료 기간 중 기승인된 병용약제의 조합이 변경되는 경우에는 사전심사를 추가로 받아야 한다.
아울러 서튜러, 델티바 등 다제내성 결핵신약을 복용 중인 환자를 진료 중인 의료기관은 환자의 전원에 유의해야 한다.
심평원에 따르면 다제내성 결핵신약을 복용 중인 환자가 사전심사 요청 의료기관에서 다른 의료기관으로 전원간 경우, 치료 방법에 따라 사전심사 여부가 달라지기 때문이다.
우선 승인된 내용과 동일하게 치료할 경우에는 재심사 없이 급여가 인정된다. 다만 청구 시 특정내역에 ‘승인 통보내역’ 등을 기술해야 한다.
하지만 승인된 병용약제 조합과 다르게 투여하는 경우에는 반드시 재심사를 받아야 하며, 심사 결과에 따라 급여 인정 여부가 달라질 수도 있다.
사전심사 결과, 통보까지 일주일
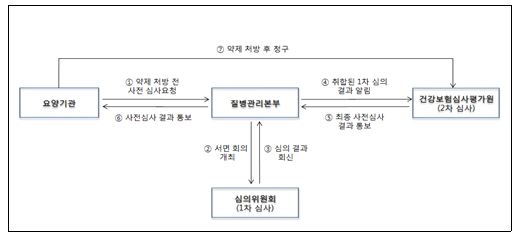
이처럼 다제내성 결핵신약 사용을 위해 사전심사를 요청한 경우, 심사결과는 최소 일주일 정도 소요될 전망이다. 최종 심사결과는 사전심사를 요청한 의료기관에 공문 형식으로 전달된다.
아울러 사전심사 승인 결과는 다제내성 결핵신약 처방 시작일부터 24주까지 유효하다.
식품의약품안전처의 서튜러, 델티바의 허가 범위에 따르면, 먼저 서튜러는 제1~2주까지 1일 1회 400mg(100mg 4정), 제3~24주까지는 일주일에 3회, 매회 200mg(100mg 2정) 한 주당 총 투여 용량 600mg이며, 델티바는 1회 100mg, 1일 2회 24주간 투여하도록 돼 있기 때문이다.
다만 다제내성 결핵신약 사용을 승인받은 경우라면 매번 약제를 처방할 때마다 사전심사를 받을 필요는 없다.
심평원은 “24주 이내 치료기간 중 병용약제의 조합 및 처방 용량이 변경된 경우 재심사가 필요하다”며 “특히 식약처 허가사항 범위 안에서만 사전심사 요청이 가능하다”고 밝혔다.
한편, 다제내성 결핵신약 처방 시 급여인정을 받으려면 반드시 사전심사를 받아야 하며, 이는 다제내성 결핵신약을 처방하는 모든 의료기관에 해당된다.

