[AACR 2021] 이중 융합 단백질 '테벤타퍼스프' 임상3상 발표
면역관문억제제 등과 비교해 전체 사망 위험 약 절반↓

[메디칼업저버 박선혜 기자] 눈에 발생하는 악성종양인 전이성 포도막 흑색종을 표적한 첫 치료제가 긍정적인 연구 결과를 근거로 임상 도입에 한 걸음 다가섰다.
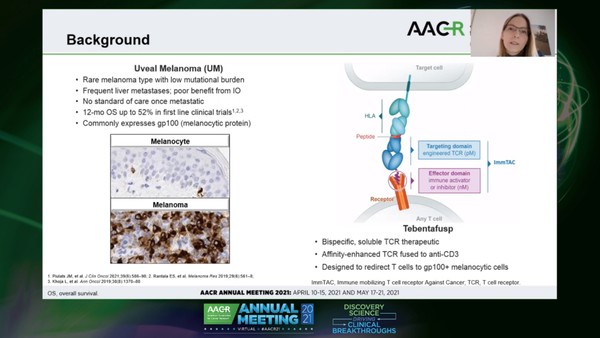
주인공은 영국 생명공학회사 이뮤노코어(Immunocore)가 개발한 이중 융합 단백질(Bispecific Fusion Protein)인 '테벤타퍼스프(tebentafusp)'다.

테벤타퍼스프의 임상3상 결과에 따르면, 면역관문억제제 등보다 테벤타퍼스프 치료 시 전이성 포도막 흑색종 환자의 전체 사망 위험이 절반가량 낮았다.
이번 연구 결과는 10~15일 온라인으로 열리는 미국암연구학회 연례학술대회(AACR 2021)에서 10일 공개됐다.
테벤타퍼스프, TCR/항-CD3 이중 융합 단백질
포도막 흑색종은 희귀질환이지만 성인에서 가장 흔한 눈암(eye cancer)이다. 모든 흑색종에서 약 3~5%를 차지한다.
포도막 흑색종 예후는 전이 후 생존기간(중앙값)이 1년 미만으로 보고되는 등 좋지 않다. 게다가 이 같은 공격적인 암에 대한 표준치료는 없다.
테벤타퍼스프는 치료 경험이 없는 수술불가 또는 전이성 포도막 흑색종 환자 치료를 위해 개발됐다. 특정 인간백혈구항원(HLA)인 HLA-A*02:01의 gp100 항원을 표적으로 한 T-세포 수용체(TCR)/항-CD3(Anti-CD3) 이중 융합 단백질이다.
테벤타퍼스프는 종양과 면역세포 사이에 다리를 만들어 면역세포가 종양을 공격할 수 있도록 한다. TCR 결합 도메인은 HLA-A*02:01의 gp100 유래 펩타이드만 인식하므로, 테벤타퍼스프는 이러한 HLA 유형을 가진 환자에게 치료제로 투약할 수 있다. 이 같은 HLA 유형은 포도막 흑색종의 영향을 크게 받는 백인의 약 50%에서 관찰된다.
전체 생존기간, 테벤타퍼스프군 5.7개월↑
임상3상에는 치료받지 않은 HLA-A*02:01 양성 전이성 포도막 흑색종 환자 378명이 모집됐다.
전체 환자군은 테벤타퍼스프군(252명) 또는 연구팀이 선택한 치료인 면역관문억제제 키트루다(펨브롤리주맙, 103명), 여보이(이필리무맙, 16명) 또는 항암화학요법 다카바진(7명) 등 치료군(대조군, 126명)에 2:1 무작위 분류됐다.
1차 목표점은 전체 생존기간, 2차 목표점은 연구자가 평가한 객관적 반응률(ORR), 무진행 생존율(PFS)이었다.
14.1개월 추적관찰(중앙값) 결과, 평균 전체 생존기간은 테벤타퍼스프군이 21.7개월로, 대조군 16개월보다 5.7개월 길었다.
전체 사망 위험은 테벤타퍼스프군이 대조군보다 49% 유의하게 낮았다(HR 0.51; P<0.0001). 이같은 결과는 모든 하위군에서 일관되게 나타났다. 1년 전체 생존율은 테벤타퍼스프군 73.2%, 대조군 58.5%였다.
무진행 생존기간은 테벤타퍼스프군이 3.3개월, 대조군이 2.9개월로, 테벤타퍼스프군의 무진행 생존율이 27% 더 좋았다(HR 0.73; 95% CI 0.58~0.94).
이어 고형암 반응 평가기준(RECIST)에 따른 반응률은 테벤타퍼스프군 9%(23명)로, 1명은 완전반응, 22명은 부분반응이 나타났다. 이와 달리 대조군의 반응률은 5%로 조사됐다.
12주째 안정적 질환을 포함한 질병 조절률은 테벤타퍼스프군 46%, 대조군 27%였다.
이와 함께 부분반응 또는 안정적 병변 상태가 아니며 질병 진행을 경험한 환자도 테벤타퍼스프의 치료 혜택을 얻을 수 있는 것으로 분석됐다. 이들 환자 중 테벤타퍼스프군의 전체 생존율이 대조군보다 좋았던 것.
아울러 안전성 평가에서 테벤타퍼스프 관련 이상반응은 예측 가능하고 관리할 수 있었다. 치료 중단율은 테벤타퍼스프군 2%로, 대조군 4.5%보다 낮았다.
구체적으로 중증 사이토카인 방출 증후군 발생률 1% 포함해 3/4등급 치료 관련 이상반응(TRAE)은 드물게 나타났다.
테벤타퍼스프군에서 가장 흔한 사이토카인 매개 TRAE는 △사이토카인 방출 증후군 89% △발열 76% △오한 47% △구역 43% △피로 41% △구토 26% △두통 22% 등 이었다.
피부와 관련된 TRAE는 △발진 83% △가려움 69% △건조 29% △홍반 23%, 가장 흔하게 보고된 3/4등급 TRAE는 △발진 18% △가려움 5%였다.
"임상3상서 전체 생존기간 개선 확인한 첫 치료제"

이번 연구를 통해 전이성 포도막 흑색종 치료제로서 테벤타퍼스프의 가능성을 확인했다는 게 전문가들의 중론이다.
연구를 진행한 독일 하이델베르크 대학병원 Jessica Hassel 교수는 "현재 전이성 포도막 흑색종 환자를 위한 표준화된 치료가 없다"며 "테벤타퍼스프는 전이성 포도막 흑색종의 1차 치료제로서 유의하게 임상적으로 전체 생존기간을 개선시켰다. 전이성 포도막 흑색종 환자의 전체 생존기간 개선을 임상3상에서 확인한 첫 치료제이며, 이러한 혜택은 RECIST 객관적 반응이 없는 환자에게서도 관찰됐다"고 강조했다.
AACR 회장인 미국 UCLA의 Antoni Ribas 교수는 "이번 연구는 포도막 흑색종 환자의 전체 생존기간 개선을 입증한 첫 임상연구"라며 "테벤타퍼스프는 성공적으로 개발된 최초 TCR 치료제이다. 진료현장을 바꿀 수 있는 연구 결과로, 실제 임상에서 이 치료제를 사용할 수 있도록 해야 한다"고 제언했다.
그러나 테벤타퍼스프는 특정 HLA 유형을 가진 환자에게만 투약할 수 있다는 한계점이 있다.
Hassel 교수는 "특정 표면 단백질이 없는 환자에 대한 미축종 수요(unmet need)는 여전히 남아있다"고 밝혔다.
한편 테벤타퍼스프는 지난 2월 미국식품의약국(FDA)으로부터 포도막 흑색종에 대한 혁신치료제로 지정됐다.

