JW중외제약, 임상2b상 결과 보고서 발표…1·2차 유효성 평가변수 충족
부작용 등 이슈로 개발 중단된 약제 많아…안전한 치료제 개발이 화두

[메디칼업저버 정윤식 기자] 한 번 발병하면 고혈압과 당뇨병처럼 완치가 힘든 만성질환인 통풍 환자가 늘고 있다.
하지만 통풍에 효과적이고 확실한 치료제, 특히 배출저하형 통풍 치료제는 현재 없는 실정인데 이는 부작용 등의 안전성 이슈 때문이다.
이처럼 마땅한 치료제가 없는 통풍 시장에서 지난해 중국 임상 허가를 받으며 글로벌 시장에 첫 발을 내디딘 바 있는 JW중외제약의 'URC102' 임상2b상 결과 보고서가 발표됐다.
서구화된 식습관 탓 환자 늘어…치료제 시장 급성장
바람만 스쳐도 극심한 고통이 느껴진다는 통풍은 대표적인 난치성 질환으로, 식습관의 서구화와 함께 국내에서도 발병률이 가파르게 증가하는 추세다.
실제로 건강보험심사평가원 보건의료 빅데이터 개방시스템에 따르면 2015년 33만여명의 통풍 환자가 2016년 37만명, 2017년 39만명, 2018년 43만명, 2019년 46만명으로 꾸준히 증가했다.
통풍은 체내에서 생성된 요산이 소변 등을 통해 배출되지 않고 쌓였을 때 발생하는 대사질환이다.
혈액이나 관절액 내 요산이 결정 형태로 남아 연골, 관절 주위의 조직, 피하조직 등에 침착돼 주기적인 염증과 통증을 유발하는데, 주기적인 육류 섭취, 과음, 과식 등이 원인이다.
환자 증가와 함께 통풍 치료제 시장도 크게 성장 중이다.
심평원 빅데이터 기준 2019년 국내 통풍 치료제 처방액은 약 340억원 규모로, 2015년 230억원과 비교해 50%가량 급성장했다.
이는 우리나라뿐만 아니라 세계적인 추세다.
글로벌 시장 조사기관 '그랜드 뷰 리서치(Grand View Research)'는 현재 약 3조원 규모의 글로벌 통풍 치료제 시장이 연평균 16.1% 성장해 2025년 9조 6000억원 대까지 성장할 것으로 전망했다.
통풍 치료제 시장은 최근 중국 정부에서 자국 내 의약품 허가 진입 장벽을 낮추려는 움직임을 보이며 블루오션으로 주목받고 있다.
전 세계 통풍 환자는 3500만명으로 추산되는데, 이 중 40%에 달하는 1400만 명이 중국 환자로 알려졌다.
반면 중국 통풍 치료제 시장 규모는 전 세계 시장의 4%(2017년 아이큐비아 기준 약 1억 514만달러)에 불과하다. 이는 중국 통풍 치료제 시장이 가진 무한한 성장 가능성을 보여주고 있는 대목이다.
배출저하형 통풍 환자 많지만…안전한 치료제 개발 화두
통풍은 자연적으로 요산이 배출되는 일반인과 달리 요산의 배출이 원활하지 못한 '배출저하형'과 체내에서 요산이 일반인보다 많이 생성되는 '과다생성형'으로 나뉜다.
현재 요산의 생성을 저하시키는 약제는 일부 출시돼있지만, 배출저하형 통풍 치료제는 많은 환자 수에도 불구하고 안전성 우려 때문에 활발하게 처방되지 못하고 있는 실정이다.
신장이나 심혈관계에 부하를 초래하는 경우가 많아 안전성을 확보하기가 쉽지 않았던 것이다.
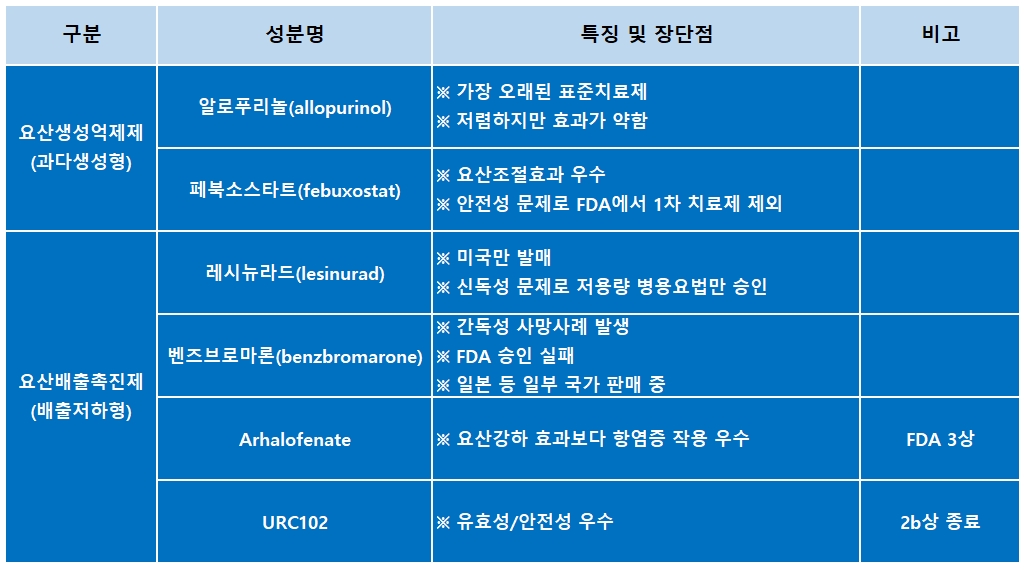
많은 글로벌 제약사가 레시뉴라드, 벤즈브로마론 등의 성분으로 치료제 개발에 열을 올리고 있지만, 부작용을 비롯한 안전성 이슈 등을 이유로 대부분 개발이 중단된 상태다.
그 어느 때보다 안전한 통풍 치료제에 대한 니즈가 더욱 커지고 있는 상황으로 볼 수 있다.
URC102 임상2b상 종료…1·2차 유효성 평가변수 충족
이런 가운데 JW중외제약이 URC102의 국내 임상2b상을 완료했다고 최근 밝혔다.
URC102는 혈액 내에 요산 농도가 비정상적으로 높은 고요산혈증으로 인한 통풍질환에 유효한 신약후보물질로, 요산 배출을 촉진시키는 작용기전을 갖고 있다.
2019년에는 중국시장에 대한 URC102의 개발·판매 권리가 심시어제약에 기술 수출된 바 있다.
임상2b상은 2019년 4월부터 중앙대병원, 한양대병원 등 국내 18개 주요 병원에서 총 171명의 한국인 통풍 환자를 대상으로 유효성과 안전성을 평가하고 적정 용량을 탐색하는 방식으로 진행됐다.
임상 2b상 투여군은 URC102 9㎎, 6㎎, 3㎎과 위약 등 총 4개 군과 참조군인 페북소스타트(Febuxostat) 80mg으로 구분했으며, 12주 동안 1일 1회 경구 투여했다.
임상 결과, 1차와 2차 유효성 평가변수를 모두 충족했고 높은 안전성과 내약성을 보였다.
1차 평가변수는 약물 투여 후 4주 시점에서의 혈청요산수치 6㎎/㎗ 이하 달성률로 URC102 9㎎군 88.89%, URC102 6㎎군 71.79%, URC102 3㎎군 54.05%, 위약군 0%로 나타나 모든 URC102 투약군의 결과가 위약군 결과 대비 통계적으로 유의했다.
참조군인 페북소스타트 80mg군의 달성률은 84.21%이었고 혈청요산수치 5㎎/㎗ 이하 달성률도 유사한 결과를 보였다.
이는 고용량일수록 평가변수 달성률도 높아지는 URC102의 '용량 의존적 반응'이 확인된 결과다.
이 결과는 4주뿐만 아니라 8주, 12주 동안에도 모든 용량군(3mg, 6mg, 9mg)에서 일관적으로 확인할 수 있었다.
또한 URC102에 의한 중대한 약물이상반응이나 위험성이 확인되지 않아 위약군과 동등한 수준의 안전성 및 내약성을 가진 것으로 평가됐다.
JW중외제약은 이번 임상2b상 결과를 바탕으로 국내·외 임상3상을 검토하는 동시에 다국적 제약사와의 글로벌 기술수출 논의에 박차를 가할 예정이다.
JW중외제약 이성열 대표는 "통풍 발병률이 크게 늘고 있지만 기존 치료제의 경우 안전성 우려로 활발하게 처방되지 못하고 있는 게 현실"이라며 "URC102의 후기 2상에서 긍정적인 결과를 확인한 만큼 높은 안전성과 우수한 유효성을 겸비한 글로벌 통풍신약으로 개발할 것"이라고 말했다.

