비편평성 폐암과 소세포암도 가능
면역항암제들의 적응증이 속속 추가되고 있다.
미FDA는 20일 KEYNOTE-189 연구를 근거를 토대로 펨브롤리주맙(제품명 키트루다)을 EGFR 또는 인산화효소(ALK) 유전적 종양이상(genomic tumor aberrations)이 없는 전이성 비편평성 비소세포폐암 환자에게 사용할 수 있는 1차 치료제로 승인했다.
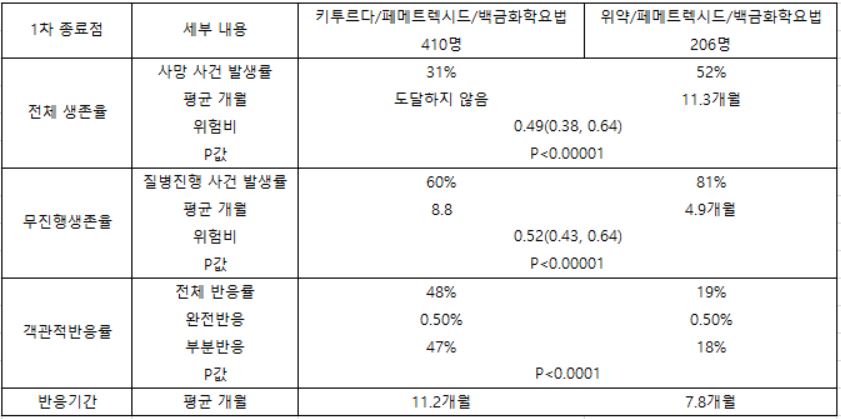
KEYNOTE-189는 전이성 비편평성 비소세포폐암 환자의 표준요법이었던 카보플라틴/페메트렉시드 치료에 펨브롤리주맙 또는 위약을 투여하고 생존율 개선 여부를 비교한 다기관 3상연구이다. 모두 616명이 참여했다.
연구 결과 펨브롤리주맙 투여군의 무진행 생존율(PFS)과 전체 생존율(OS)은 대조군대비 각각 48%와 51% 개선됐다. 이 결과는 올해 미국임상종양학회(ASCO)에서 발표됐고 당시 편평성에 이어 비편평성 폐암에서도 생존율 개선 가능성을 확인한 첫 연구라는 평가를 받았다.
이보다 앞서 지난 17일에는 니볼루맙이 소세포암 적응증을 추가했다. 미국FDA는 CheckMate -032 연구를 근거로 니볼루맙(제품명 옵디보)을 이전 치료경험이 있는 소세포암 폐암환자를 위한 치료제로 승인했다. 소폐포폐암에서 면역항암제가 적응증을 획득한 것은 이번이 처음으로 거의 20년만의 새로운 약물이 탄생한 셈이다.
근거가 된 CheckMate -032 연구는 이전 백금화학요법 치료경험이 있는 소세포폐암 환자에게 니볼루맙 단일요법을 투여한 1/2상 연구이다. 245명 환자가 참여했고, 현재도 연구가 진행 중이다.
지금까지 109명의 환자에 대한 분석이 완료됐고, 이중 12%가 PD-L1 발현율에 상관없이 반응을 보이는 것으로 나타났다. 12명의 부분반응을 1명은 완전반응이었다. 반응자 중 질병진행까지 걸린 평군 기간 17.9개월이었다.
이로서 니볼루맙은 전이성 비소세포폐암, 재발성 또는 전이성 편성세포 두경부암과 더불어 적응증이 3개로 늘어났다.
한편 미FDA는 지난 16일 REFLECT 연구를 근거로 렌바티닙(제품명 렌비마)을 절제불가능한 간세포암 1차 치료제로 허가했다. REFLECT 연구는 현재 사용되고 있는 간암치료제 소라페닙과 비열등성 연구로 진행됐는데, 전체 생존율이 각각 13.6개월과 12.3개월로 나왔다. 이 연구는 지난 2017년 ASCO에서 발표됐었다.
