대한심장학회 추계학술대회 16~18일 개최
KorHF III 등록사업 기반으로 FINEARTS-HF 연구·FDA/EMA 기준 적격성 분석
FINEARTS-HF 참여/제외 기준에 부합한 환자 18.3%에 그쳐
[메디칼업저버 박선혜 기자] 국내 심부전 환자에게 케렌디아(성분명 피네레논)의 주요 임상연구 기준과 국외 허가사항을 적용할 경우 충족하는 비율이 낮은 것으로 조사됐다.
케렌디아의 심부전 환자 대상 FINEARTS-HF 임상연구 모집 기준을 국내 심부전 등록사업(KorHF III Registry)에 적용한 결과, 참여/제외 기준에 적격한 환자는 18.3%에 그쳤다. 게다가 미국식품의약국(FDA)/유럽의약품청(EMA)의 허가 기준을 적용하면 그 비율이 더 줄었다.
세브란스병원 김무준 임상강사(심장내과)는 16~18일 그랜드 워커힐에서 열리는 대한심장학회 추계학술대회에서 이번 연구 결과를 소개했다.
FINEARTS-HF 모집 기준 엄격해 진료현장에 일반화 어려워
케렌디아는 2형 당뇨병 동반 만성 콩팥병 뿐만 아니라 미국식품의약국(FDA)으로부터 좌심실 박출률(LVEF) 40% 이상 심부전 환자 치료제로 허가받았다. 게다가 지난 16일 미국에 이어 전 세계 두 번째로 국내에서도 좌심실 박출률 40% 이상인 만성 심부전 적응증을 획득했다.
이 같은 허가 근거는 좌심실 박출률 40% 이상인 박출률 경도감소(HFmrEF) 또는 박출률 보존(HFpEF) 만성 심부전 환자를 대상으로 진행된 FINEARTS-HF 임상3상이다. 그러나 임상연구는 모집 기준이 엄격해 실제 진료현장에 일반적으로 적용하기 어렵다는 한계가 있다.
이에 이번 연구는 실제 국내 진료현장의 심부전 환자가 FINEARTS-HF 모집 기준과 FDA/EMA 제품 라벨 기준에 어느 정도 부합하는지 평가하고자 진행됐다.
FDA/EMA 기준 해당하는 KorHF III 환자는 4.2%에 불과

분석 대상은 2018~2022년 KorHF III 등록사업에 모집된 급성 심부전 환자 7351명이었다.
이 중 FINEARTS-HF 모집 기준에 해당하지 않는 40세 미만, NYHA 기능 등급 I 또는 분류 누락, 좌심실 박출률 40% 미만, 입원 중 사망 등 환자를 제외하면 2120명(29.5%)만 기준에 해당됐다.
이에 더해 제외 기준도 적용하면 부합한 환자가 더 줄어, 단 1312명(18.3%)만 최종 FINEARTS-HF 참여 기준을 충족했다.
KorHF III 등록사업의 심부전 환자가 FINEARTS-HF에서 제외되는 주요 이유로 헤모글로빈 수치(<10g/dL), 추정 사구체여과율(eGFR)(<25mL/min/1.73m²), 혈청 칼륨(>5.0 mmol/L) 등이 지목됐다.
그러나 FDA/EMA 제품 라벨의 배제 기준에 해당하는 환자를 제외하면, KorHF III 등록사업에서 적합한 환자는 단 305명(4.2%)에 불과했다.
제외된 환자 대부분은 2형 당뇨병 동반 만성 콩팥병이 없거나(90.5%), eGFR이 25mL/min/1.73m² 미만, 혈액 또는 복막투석을 받는 말기 신질환, 혈청 칼륨 5.0 mmol/L 초과 등에 해당됐다.
임상연구·FDA/EMA와 KorHF III 등록사업 환자군의 특징 차이 보여
이와 함께 FINEARTS-HF 환자군과 해당 모집 기준에 부합한 KorHF III 등록사업 환자군의 등록 당시 특징에도 차이가 확인됐다.
환자군의 나이는 비슷했지만, FINEARTS-HF와 비교해 KorHF III 등록사업 환자군에는 여성이 더 많이 포함됐고 체질량지수(BMI)가 낮았으며 심부전으로 인한 입원도 적었다. 또 수축기혈압, 혈청 크레아티닌, NT-proBNP 수치가 더 높았다.
아울러 KorHF III 등록사업 환자군 대부분이 진행된 NYHA 기능 등급을 보여, 3명 중 2명이 III 또는 IV에 해당했다. 약물치료의 경우 ACEI/ARB/ARNI와 베타차단제, SGLT-2 억제제 치료율이 FINEARTS-HF보다 더 낮았다.
이어 KorHF III 등록사업에 FINEARTS-HF 참여/제외 기준을 모두 적용했을 때 적합한 환자군과 FDA/EMA 제품 라벨 기준을 충족한 환자군의 등록 당시 특징을 비교했다.
그 결과, FDA/EMA 제품 라벨 기준에 적합한 환자군은 2형 당뇨병 동반 만성 콩팥병 기준으로 인해 혈청 크레아티닌 수치가 높았고 NT-proBNP 수치도 상승했다. 또 심부전으로 인한 입원율이 높았으며 좌심실 박출률 40~50%에 속하는 환자가 더 많았다.
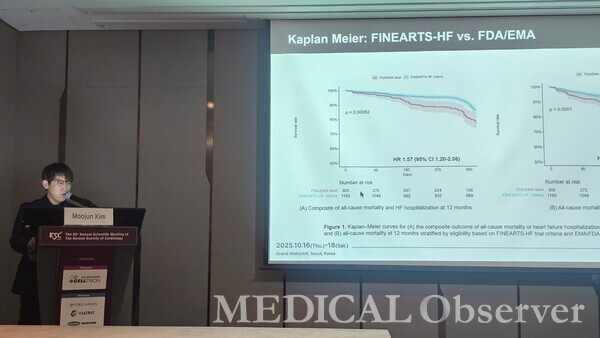
게다가 KorHF III 등록사업에서 FDA/EMA 제품 라벨 기준을 충족하는 환자 수가 적음에도 불구하고, 이들은 FINEARTS-HF 참여/제외 기준에 부합하는 환자군과 비교해 1년째 모든 원인에 의한 사망 위험이 1.85배 유의하게 높은 것으로 나타났다.
모든 원인에 의한 사망에 더해 심부전으로 인한 입원을 종합적으로 평가해도 1년째 위험이 1.57배 높아, 예후 악화 가능성이 더 크다는 것을 시사했다. 이는 임상적으로 케렌디아의 미충족 수요가 있는 환자군이 존재한다는 것을 의미한다.
심부전 표준치료에 케렌디아 추가 투약 시 비용 효과적
아울러 케렌디아는 국내 심부전 환자 치료에 비용 효과적이라고 조사됐다.
케렌디아의 비용-효용성 분석 결과, 표준치료에 케렌디아를 병행할 경우 1QALY를 얻는 데 드는 추가 비용을 의미하는 점증적 비용-효과비(ICER)가 5376달러로 추산됐다. 이는 1QLAY를 위한 최대 지불의사금액(WTP)인 2만 1000달러보다 크게 낮은 수치다.
김 임상강사는 "FDA/EMA 허가 기준을 충족하는 KorHF III 등록사업의 환자군은 적지만 임상적 위험 프로파일이 높다는 것을 이번 연구에서 확인했다"며 "표준치료에 케렌디아를 추가할 경우 ICER가 WTP보다 크게 낮아, 국내 진료현장에서 케렌디아를 투약하는 것이 비용 효과적인 것으로 보인다"고 결론 내렸다.
