
조직·세포·장기 등의 점진적 퇴행(deterioration)으로 기능 저하, 장애가 나타나는 퇴행성 변화(degenerative change)가 질병의 핵심병변으로 대두된 것은 의학의 역사에서 비교적 최근의 일이다.
외상, 감염에서 암성 병변, 염증성, 대사성, 유전성 질환으로 질병의 진단과 치료가 발전해 오는 가운데, 퇴행성 질환에 대한 병태생리, 임상경과, 의학적 관리에 대한 관심으로 현대의학이 점차 이동하고 있다.
아직 인류가 경험하지 못한 전면적인 초고령사회가 다가오면서, 임상현장에서는 노화 및 만성질환과 직결되는 퇴행성 질환을 어떻게 진단하고 치료할지, 어떻게 예방할 수 있을지에 대한 의학적·사회적 논의가 활발하다.
초고령시대에 향후 30년 정도 우리 앞에 펼쳐지게 될 새로운 지평(New horizon) 위에 노인 근골격계 질환의 관리는 어떤 모습으로 놓여 질 것인가?
이를 그려내기 위해 현 시점에서 고려할 만한 주요 문제들을 인구의학적 환경변화, 진단과 치료기술 발전, 패러다임의 전환 또는 확장 측면에서 논의해 보고자 한다.
노인의 퇴행성 근골격계 질환
근골격계의 퇴행성 질환은 크게 뼈, 관절, 근육 및 연부조직의 병변으로 분류할 수 있다. 뼈와 관절에 생기는 대표적 퇴행성 질환으로 골다공증과 골관절염은 잘 알려져 있고, 이미 진단기준과 치료관리 지침이 많이 나와 있다.
근육의 퇴행성 변화를 질병으로 인식한 것은 비교적 최근으로 2010년에 처음 근감소증에 대한 진단기준이 발표된 이래로 현재까지 수차례의 진단기준 보완·개정이 진행되고 있고, 각 나라의 국제질병분류 ICD-10에 차례로 등재되고 있다.¹
한편 연부조직 즉, 건(힘줄)·인대·근막·섬유조직 등 결체조직의 퇴행성 변화들은 역학적 완전성의 훼손과 손상에 대한 취약성으로 파열과 불완전 회복이 반복되게 돼, 근골격계 통증의 가장 흔한 원인병변이 된다.²(그림)
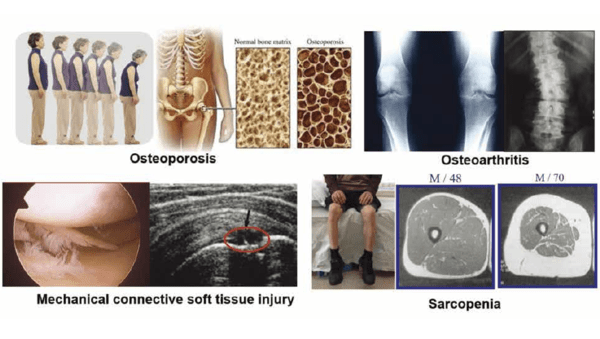
뿐만 아니라, 본래의 역학적 지지 기능을 유지하지 못해, 뼈와 관절에 2차적 퇴행성 변화를 초래하게 된다. 일종의 퇴행성 악순환의 고리(degeneration vicious cycle)가 형성된다.
노년기 근골격계 질환의 관리는 현재 통증과 기능장해의 핵심병변을 잘 찾아내고, 회복을 촉진하고 재손상을 예방하는 다양한 치료 modalities 즉, 약물치료·시술중재·재활운동·행동요법 등을 적절하게 적용해 최적의 효과를 도모하는 것이다.
물론 단편적, 대증적 치료를 잘 제공해야겠지만, 질병의 자연경과를 이해하고 임상경과를 잘 추적해 과거에서 현재까지의 궤적을 바탕으로 미래 경로를 예측하는 과정이 포함돼야 한다.
퇴행성 근골격질환의 New Normal
임상현장에서 퇴행성 근골격질환의 비중이 점점 더 높아질 것이 자명하다. 특히 노인 특성화 진료를 하지 않더라도 외래·입원 환자의 대부분이 노인이 될 것이고, 80·90대의 초고령 노인들의 방문이 특히 빠르게 증가할 것이다.
이 연령대 대부분이 퇴행성 변화를 갖고 있고, 노쇠(frailty)·취약성(fragility) 상태에 놓여 있게 된다.
노쇠, 근감소증, 취약골절(fragility fractures), 비사용증후군(disuse syndrome) 등으로 현저한 기능저하와 일상생활동작 수행에 도움이 필요한 장애 상태에 대한 포괄적 관리와 재활, 그리고 돌봄 요구가 증가할 것이다.
한편, 퇴행성 근골격질환에서 정상과 비정상을 판단하는 기준에 대한 새로운 고려와 기존의 임상진료지침이 적절한가에 대한 논의가 필요할 것이다.
예를 들어 80·90대 노인의 골관절염, 골다공증 유병률과 치료제 선택에 대해 현재의 가이드라인이 얼마나 도움이 되는가?
대부분 90대 노인의 악력이 근감소증 진단기준에 포함될 만큼 저하돼 있다면, 그들이 모두 근감소증 환자인가, 또한 청장년 환자의 생역학적 데이터에 기반한 운동방법들이 초고령 노인에게 똑같이 적용될 수 있을까, 또한 이들에게 재활의 목표를 어디에 두어야 할까 등 많은 핵심질문들에 대해 답을 찾아야 한다.
진단과 치료기술 발전
퇴행성 근골격질환의 진단을 위한 신체검진, 영상검사, 바이오마커, 생역학지표 등 진단도구들에는 어떤 발전을 기대할 수 있을까? 퇴행성 변화 가운데 급성 손상, 증상 악화(acute-on-chronic)를 객관적으로 잘 구분해 내는 것이 중요하다.
사실 종양진단의 발전에 비하면 퇴행성 근골격질환에서는 각종 진단방법들이 부정확하고 제한적이다. Dynamic or loaded MRI, 3D 동작분석, 운동형상학/역학적 데이터의 고도화, 인공지능 알고리즘 적용 등이 혁신적인 진단·평가 방법들로 유망하다.3,4
또한 퇴행성 변화를 늦추거나 개선하려는 다양한 신약, 신의료기술이 New horizon에 올라 올 것이다. 골다공증, 골관절염에서 질병조절(Disease modifying) 약물들이 임상현장에서 사용되고 있거나 임상시험 중이다.5
근감소증 치료제들도 본격적으로 임상시험 중이고 곧 임상에서 사용할 수 있을 것으로 기대되고 있다.6
퇴행성 병변에 대한 재생의학적 접근은 계속 시도될 것이다. 줄기세포와 성장인자에 조직공학 기술을 접목해 관절, 근육, 연부조직 퇴행 병변에 재생을 시도하고 있다.7
전신성 퇴행 병변에 대해서는 적용하기 어렵지만, 국소 손상이나 국소적 퇴행성 병변에 대해서 재생의학적 치료는 많은 기대를 갖게 했다. 아직까지 임상적 유용성이 확보되지 못했으나, 향후 지속적인 임상적용이 시도될 것이다.
질병조절 약물(Disease modifying agents), 재생의학 시대에 노인성 근골격계 질환 분야에는 어떤 기회와 도전이 있을까? 약물, 생역학, 조직공학의 융합치료가 주요 메뉴로 올라올 것으로 기대한다.
패러다임의 전환∙확장
퇴행성 질환의 증가와 진단 및 치료기술 발전은 장기 생존 유병자, 특히 취약한 생존자의 폭발적 증가를 가져오게 된다.
이들의 생애전반(life-long)에 겪게 되는 근골격계 통증, 신체기능 저하에 대한 관리와 재활은 기존 전통적 치료 패러다임 내에서 감당할 수 없다. 패러다임의 새로운 전환과 확장을 요구하고 있다.
대표적으로 근골격질환으로 수술치료를 받은 환자들의 생애전반 경과에서 나타나는 다양한 문제들을 만나게 될 것이다.
예를 들어 척추 고정술을 받은 환자들에서 인접 분절 퇴행성 병변(Adjacent segmental degeneration)으로 고통받는 환자들이 늘고 있다.
또한 슬관절, 고관절 전치환술, 회전근개 수술을 받은 환자들의 장기적 합병증 관리, 재수술 후 재활과 장애 관리 이슈가 있다.
현재 퇴행성 근골격질환과 연관된 뇌신경계의 변화, 즉 신경가소성에 대한 연구가 계속되고 있다.8,9 만성 퇴행성 근골격질환에서는 말단의 근골격계의 변화와 중추의 신경계 변화가 통합돼 나타난다는 증거들이 많이 나오고 있다.
신경계 재활에 적용되는 여러 재활방법들이 만성 근골격계 통증 조절에 사용되고 있으며, 임상적 근거가 축적되고 있다. 새로운 재활방법의 개발과 근거 확립에 앞으로 많은 연구가 필요하다.
마지막으로 뇌신경계 질환 환자들이 장기 생존하면서 노년기에 겪게 되는 다양한 근골격계 문제들에 대해 적절하게 평가하고 관리할 수 있어야 한다.
한 예로 파킨슨병 환자들에게 퇴행성 근골격계 변화와 근골격계 통증이 상당히 흔하다. 또한 뇌졸중 환자들의 마비 측 상하지 근육의 경직과 변성으로 근위축 및 근감소증 상태가 지속해 보행기능이 전보다 떨어지는 경우가 있다.
뇌신경계 질환 환자들의 기존 장애 상태가 새로운 근골격계 문제로 더 악화되면, 재활전략을 수정하고 새로운 계획을 짜야 할 것이다.
맺음말
골다공증, 골관절염, 근감소증 등 퇴행성 근골격계 질환은 초고령시대에 전 의학 분야의 주목을 받는 대표적 Geriatric Giant(핵심 노인성질환)이다.
지난 수십년간 축적된 근골격계 질환의 관리 원칙과 방법들이 지속 발전하면서 신약, 신의료기술과 접목한 새로운 치료 및 관리 방법들이 개발될 것이다.
또한 생애주기와 질병 단계에 맞춘 관리 전략들이 임상근거를 확보해 노인 근골격계 질환 관리의 새로운 지평 위에 올라올 것이다. 이제 본격적으로 준비할 때다.
Reference
1. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48(1): 16-31.
2. Chung SG. What is on the horizon? Adding a new item to our list: mechanical connective soft tissue. PM R 2012; 4(4): 247-51.
3. Borotikar B, Lempereur M, Lelievre M, Burdin V, Ben Salem D, Brochard S. Dynamic MRI to quantify musculoskeletal motion: A systematic review of concurrent validity and reliability, and perspectives for evaluation of musculoskeletal disorders. PLoS One 2017; 12(12): e0189587.
4. Gyftopoulos S, Lin D, Knoll F, Doshi AM, Rodrigues TC, Recht MP. Artificial Intelligence in Musculoskeletal Imaging: Current Status and Future Directions. AJR Am J Roentgenol 2019; 213(3): 506-13.
5. Persson MSM, Sarmanova A, Doherty M, Zhang W. Conventional and biologic disease-modifying anti-rheumatic drugs for osteoarthritis: a meta-analysis of randomized controlled trials. Rheumatology (Oxford) 2018; 57(10): 1830-7.
6. Kwak JY, Kwon K-S. Pharmacological Interventions for Treatment of Sarcopenia: Current Status of Drug Development for Sarcopenia. Ann Geriatr Med Res 2019; 23(3).
7. Lewis R, Gomez Alvarez CB, Rayman M, Lanham-New S, Woolf A, Mobasheri A. Strategies for optimising musculoskeletal health in the 21(st) century. BMC Musculoskelet Disord 2019; 20(1): 164.
8. Roy JS, Bouyer LJ, Langevin P, Mercier C. Beyond the Joint: The Role of Central Nervous System Reorganizations in Chronic Musculoskeletal Disorders. J Orthop Sports Phys Ther 2017; 47(11): 817-21.
9. Pelletier R, Higgins J, Bourbonnais D. Is neuroplasticity in the central nervous system the missing link to our understanding of chronic musculoskeletal disorders? BMC Musculoskelet Disord 2015; 16: 25.
