
지난 4월에 개최된 ‘폐암에서의 호중구감소증 관리’에 이어 최근 부인암 영역에서 ‘Management of Neutropenia in Ovarian Cancer’를 주제로 좌담회가 개최됐다. 이번 좌담회에서는 김상운 교수(연세암병원)를 좌장으로 장하균 교수(고대안산병원) 및 박정열 교수(서울아산병원)의 발표가 있었다. 본지에서는 이날의 강연 및 토의 내용을 요약·정리했다. |
Update on Management of Neutropenia: Global Guideline

연자 장하균 교수(고대안산병원 산부인과)
항암화학요법 후에 흔히 발생하는 골수기능 억제는 혈액학적 독성으로 인해 호중구감소가 심한 합병증 발현으로 이어질 수 있다.
특히 발열성호중구감소증(febrile neutropenia, FN)은 단기적으로 감염증과 패혈증을 유발해 환자를 조기 사망에 이르게 할 수 있으며, 장기적으로는 항암요법 지연 및 용량 감량에 의한 상대적 용량강도(relative dose intensity, RDI)의 감소를 일으켜 항암치료의 효과를 낮추고 부정적인 예후를 초래해 생존율을 낮춘다.
FN은 이상사례 공통용어기준(CTCAE)에 따라 절대호중구수(absolute neutrophil count, ANC) 1,000/㎜3 이하이며 발열이 있는 경우는 3등급, 긴박한 중재(urgent intervention)가 필요하며 생명이 위급한 경우는 4등급으로 구분한다.
유방암은 항암요법 1주기에서 FN 발생률이 가장 높았고, FN으로 1주일 이상 항암요법이 지연되거나 RDI가 감소된 경우가 30-60%로 매우 높았다(Culakova et al. SpringerPlus. 2015). 비호지킨 림프종 환자에서 FN을 경험한 환자는 FN이 없는 환자에 비해 사망률이 15% 이상 높게 확인되었다(Lyman GH et al. Cancer. 2010).
G-CSF (granulocyte colony-stimulating factor)는 골수를 자극하여 호중구 생성을 촉진하는 약물로 세포독성 항암요법 후 호중구감소증 예방 및 치료에 사용되고있다.
그러나 1세대 G-CSF는 반감기가 3-4시간으로 짧아 약효 지속성에 대한 문제점이 제기되었고, 이를 보완해 지속적으로 작용하는(long acting) 2세대 G-CSF가 개발되었다. 그중 pegteograstim(뉴라펙®)은 1세대 G-CSF를 페길화(pegylation, PEG)한 제제 중 대표적인 약제로, 자가투여보조기구인 허그펙(HugPEG, 뉴라펙® 전용)을 이용해 집에서 자가투여할 수 있다.
PEG G-CSF를 항암요법 2일째에 투여한 결과, ANC 최저치(nadir)에 도달하는 기간이 단축되는 것을 확인하였다<그림 1>.
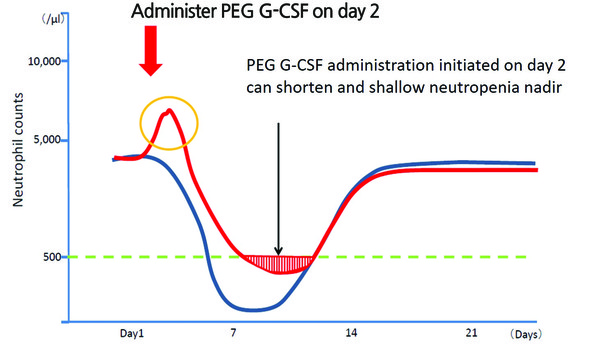
실제 임상 사용경험에서 PEG G-CSF 사용 후 ANC 감소로 인한 항암요법의 지연 사례는 관찰되지 않았다.
미국종합암네트워크(NCCN) 지침에서는 임상근거에 따라 항암요법 약제를 FN 발생 위험도별로 분류하였는데, FN 발생 위험도가 20% 이상인 난소암 치료에 사용하는 topotecan, docetaxel은 FN 고위험도 약제에 해당하며, 자궁경부암에서 주로 사용하는 cisplatin/topotecan, paclitaxel/cisplatin 및 topotecan, irinotecan 요법과 난소암의 carboplatin/docetaxel 요법은 FN 발생 위험도가 10-20%인 FN 중간위험도 요법이다.
NCCN 지침은 고위험도 요법으로 치료받은 모든 환자에게 예방 목적으로 G-CSF를 사용하도록 하였고, 중간위험도 요법으로 치료받은 환자에 대해서는 환자의 위험인자를 평가해 G-CSF 사용을 고려하도록 했다. 위험인자는 고령(65세 이상), FN 과거력, 낮은 활동도(poor performance) 등이 해당된다.
특히, COVID-19 시기에는 FN 발생을 더욱 줄이기 위해 10% 미만에 해당되는 저위험도 요법으로 치료받은 환자에게도 예방적으로 G-CSF를 사용할 것과 병원 감염을 예방할 목적으로 병원 방문을 최소화하기 위해 가능한 자가투여 방식을 선택할 것을 권고했다.
2차 예방 목적으로 G-CSF를 투여하는 경우는 이전 항암요법에서 호중구감소증으로 인한 합병증이 있었던 환자를 대상으로 한다. G-CSF를 사용한 경험이 없으면 G-CSF의 사용을 고려할 수 있고, G-CSF를 사용한 경험이 있으면 항암제의 용량을 감량하거나 항암요법 약제의 변경을 고려할 수 있다.
이처럼 G-CSF는 치료에서 예방이라는 새로운 처방 패러다임으로 영역을 확대했다. 그럼에도 불구하고 현재 국내 보험급여에서 인정되는 항암요법은 상당히 제한적인 실정이다. 난소암 치료에 주로 사용하는 docetaxel/carboplatin, topotecan 약제 등에 대해서도 보험급여 기준이 확대되어 보다 많은 환자들이 안전하고 효과적으로 치료의 혜택을 누릴 수 있기를 기대한다.
Real World Experience of Pegteograstim

연자 박정열 교수(서울아산병원 산부인과)
FN은 항암요법 약제의 위험도만으로 발생 위험을 예측하기 어렵고, 환자의 전신상태에 따라 다양하게 나타날 수 있다. 일례로 호중구감소증 발생 위험성이 낮은 저위험군 항암요법을 1차례 실시한 환자에서 패혈증 쇼크가 발생하고, 이로 인해 사망에 이르기도 하였다.
따라서 FN 발생 위험을 항암요법 약제에 따라 고위험군부터 저위험군으로 단순하게 분류하기 보다는 각 환자의 상태를 평가해 개별화된 치료 접근을 할 필요가 있다. 그러므로 FN 예측 모델을 개발해 항암요법 조기에 FN 고위험 환자를 선별하고 조기부터 G-CSF를 예방적으로 투여해 적극적으로 관리한다면 좀 더 긍정적인 항암요법 효과를 기대할 수 있을 것이다.
Pegteograstim과 같은 2세대 G-CSF는 작용시간은 늘리고 투여 빈도는 줄인 반면, 항암요법 후 약 24시간 뒤에 투여해야 하므로 입원을 연장하거나 퇴원 후 집 근처 병·의원을 찾는 경우가 잦았다. 그러나 뉴라펙®은 자가투여보조기구인 허그펙이 있어 pegteograstim 투여만을 위한 입원 연장 및 외래 방문을 줄일 수 있어 복약순응도 향상에 도움이 된다.
허그펙은 퇴원 후 간편하고 안전하게 주사할 수 있도록 돕기 위해 배흘림 디자인이 적용되어 있을 뿐만 아니라, 주사기 바늘이 노출되지 않아 가정에서 발생할 수 있는 주사 찔림 사고를 예방할 수 있다. 또한 주사 바늘을 보지 않고도 피하에 최적화된 깊이와 각도로 투약할 수 있어 환자들의 불안과 통증을 줄였다.
유방암 환자를 대상으로 pegteograstim과 pegfilgrastim을 비교 평가한 연구 결과에서 pegteograstim은 ANC 500/㎜3 미만으로 저하한 기간이 1.64일로 확인되어 비열등함을 확인하였고, ANC 2000/㎜3 이상으로 회복된 기간은 8.85일로 유의하게 단축됨을 확인하였다(Lee KH et al. Support Care Cancer. 2016)<그림 2>.
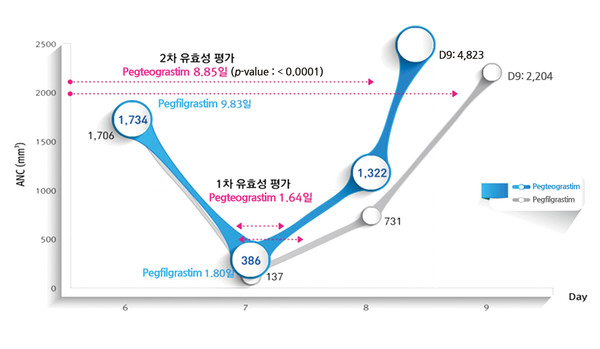
최근에는 이러한 연구결과와 임상에서의 사용 경험이 축적되어 1차 예방 목적으로의 G-CSF 투여가 증가하는 추세이다.
향후 부인암 항암요법 영역에서의 대규모 임상시험을 통해 FN 예측 모델이 개발되고, 더불어 G-CSF의 국내 급여 인정 범위가 확대된다면 더 많은 부인암
환자에게 도움이 되리라 전망한다.
Discussion
김상운: 본원에서는 carboplatin+paclitaxel 항암요법 후 다음 주기 항암요법 직전에 혈액검사를 하고 있습니다. 항암요법 후 혈액검사를 어느 시기에 하시나요?
박정열: 항암요법 1주일 후에 혈액검사를 시행해서 FN과 패혈증의 발생을 예방하고, 출혈 위험성을 모니터링합니다. 예방적으로 pegteograstim을 투여받은 환자에서 ANC 저하 양상이 보여도 이미 투여된 PEG G-CSF가 호중구 생성을 자극하고 있기 때문에 1세대 G-CSF를 추가로 투여하지 않고 경과를 관찰합니다.
장하균: 항암요법 1주일 후에 추적 검사를 정기적으로 실시합니다. 예방 목적의 G-CSF는 2주기 항암요법 후부터 사용하고 있습니다. Pegteograstim은 항암요법 24시간 후에 투여해야 하므로 자가투여해야 하는 어려움이 있습니다. 이때, 뉴라펙®은 허그펙을 이용해 투여가 용이하고 안전합니다. 반면 자가투여보조기구가 없는 경우에는 PEG G-CSF 투여 후 바늘이 없어져 응급실을 내원하는 등 이차적으로 문제가 발생하는 사례가 있었습니다. 이러한 문제점 개선을 위해 약제 선택 시 환자들이 안전하게 자가투여할 수 있는 약제를 고려해 볼 필요가 있습니다.
김상운: 실제 임상에서 예방 목적의 G-CSF 사용에 대한 보험급여 기준 확대가 시급한 부인암 영역의 항암요법은 어떤 것이 있다고 생각하십니까?
박정열: 부인암 항암요법 중 paclitaxel/carboplatin, paclitaxel/cisplatin, docetaxel/carboplatin, docetaxel/cisplatin, 표적치료제를 병합하는 3제요법 및 docetaxel/gemcitabine, adriamycin/ifosfamide 등의 4제요법에서도 예방 목적으로의 급여 확대가 필요하다고 생각합니다.
김상운: 호중구감소증 환자에서 1세대 G-CSF와 2세대 G-CSF를 선택하는 기준이 있으신가요?
장하균: 1세대 G-CSF는 항암치료 후 호중구감소증이 발생한 경우에 투여하고, 2세대 G-CSF는 항암치료 후 호중구감소증 이력이 있었던 환자에게 항암치료 다음날 예방 목적으로 투여합니다. 그러나 최근에는 예방 목적으로 2세대 G-CSF 투여가 증가하는 추세입니다.
김상운: 2세대 G-CSF의 가장 큰 장점은 어떤 점인가요?
장하균: 1세대 G-CSF는 반감기가 3~4시간으로 짧아서 치료 목적으로는 사용 가능하지만 예방 목적으로 투여하기는 어렵습니다. 반면, 2세대 G-CSF는 작용시간이 길어서 항암치료 며칠 후에 발생하는 호중구감소증 예방 목적으로 사용할 수 있다는 장점이 있습니다.
박정열: 2세대 G-CSF는 호중구감소증 예방에 효과적이므로, 호중구감소증으로 인한 FN, 패혈증 등의 합병증 발생을 줄이고, 합병증이 발생한다고 하더라도 증상을 약화시키는 것이 가장 큰 장점이라고 생각합니다. 또한 호중구감소증으로 인한 항암요법의 지연 및 용량 감량을 줄일 수 있습니다.

