
2023년 2월 24일 BrightEN HER fuTUre DESTINY: ENHERTU® Launch에 관한 내용으로 심포지엄이 진행됐다. 본 심포지엄에서는 Overview of current HER2+ mBC treatment and unmet needs in Korea 강의를 시작으로 DESTINY-Breast 01, 03 임상을 주제로 ENHERTU®, The next chapter of HER2+ mBC treatment: PART 1, 2와 Building confidence in the safe use of ENHERTU®에 대한 강의가 이어졌다. 박연희 교수(삼성서울병원)가 좌장을 맡고, 임석아 교수(서울대학교병원), 이근석 교수(국립암센터), Prof. Javier Cortes (International Breast Cancer Center, IBCC), 정경해 교수(서울아산병원)가 강의를 진행했다. 본지는 이날의 강연 내용을 요약 정리했다. |
Overview of Current HER2+mBC Treatment and Unmet Needs in Korea

연자 임석아 교수(서울대학교병원 혈액종양내과)
“HER2 양성 암 표적하는 차세대 ADC, 엔허투®
치료 옵션 부족했던 전이성 유방암의 미충족 요구 개선 기대”
인간 표피성장인자 수용체 2(human epidermal growth factor receptor 2, HER2) 양성 유방암은 암세포의 성장을 촉진하는 HER2 유전자가 과발현하여 상대적으로 나쁜 예후를 보이며 재발 위험성이 높은 특징이 있다. 하지만 HER2를 표적하는 다양한 표적항암제의 개발로 HER2 양성 유방암의 생존율은 개선되어 왔다.
HER2 과발현 세포에서는 다양한 이합체(dimerization) 과정을 통해 신호전달이 진행되는데, pertuzumab과 trastuzumab은 각각 HER2의 domain 2와 4에 결합해 신호를 차단하는 상호보완적 기전을 통해 HER2 양성 전이성 유방암의 1차 치료에서 중요한 역할을 하고 있다(1).
최초의 분자표적치료제인 trastuzumab은 1998년 처음으로 FDA 승인을 받았고, 2007년 첫 tyrosine kinase inhibitor (TKI)인 lapatinib이 상용화 되었으며, 2012년 CLEOPATRA 임상 연구가 발표되면서 pertuzumab이 사용되었고, 연이어 2013년 EMILIA 임상 연구를 통해 항체약물접합체(antibody drug conjugate, ADC)인 trastuzumab emtansine(T-DM1)이 승인 받았다.
이후 약 7년의 time lag를 거쳐 2019년, 각고의 노력을 통해 개발된 trastuzumab deruxtecan(T-DXd)의 DESTINY-Breast01(DB-01)연구를 필두로 neratinib, tucatinib, margetuximab 등 다양한 약제들이 최근 3년 사이 HER2 양성 전이성 유방암 3차 이상 치료에서 FDA 승인을 받았다.
T-DXd는 DESTINY-Breast03(DB-03)연구를 바탕으로 2차 이상의 표준 치료옵션으로 주요 가이드라인에서 자리 잡으며 전이성 유방암 치료에 새로운 패러다임을 제시했다. T-DXd는 현재 HER2 양성 전이성 유방암뿐만 아니라 HER2 저발현 유방암 및 다양한 암종에 대한 광범위한 임상을 진행 중이다.
What is the preferred 1st line regimen?
전이성 유방암 치료에서 HER2를 이중으로 억제하는 것이 효과적이라는 점은 CLEOPATRA 연구를 통해 입증되었다(2,3). HER2 양성 전이성 유방암 환자에서 기존의 docetaxel+trastuzumab 표준요법과 비교하여 pertuzumab 추가 시 무진행생존기간(progression-free survival, PFS)이 1년 6개월까지 연장되는 의미있는 결과를 보였다. 전체생존기간(overall survival, OS)은 56.6개월로 표준요법에 비해 약 15.7개월 개선되어 1차 치료로 인정됐다.
PERTAIN 임상 연구를 통해 HR 양성/HER2 양성 전이성 유방암 환자에서 taxane 치료 후 aromatase inhibitor (AI)+trastuzumab+pertuzumab 병용요법과 AI+trastuzumab 치료를 비교했다(4). AI+trastuzumab+pertuzumab 병용요법군의 PFS 중앙값(median PFS, mPFS)은 19개월로 대조군의 16개월에 비해 약 3개월 연장되었고 OS 중앙값(median OS, mOS) 또한 3개월 연장된 60개월을 보여주며 pertuzumab 추가에 따른 치료 혜택을 확인했다(5,6).
What is the preferred 2nd and later line regimen?
HER2 표적 ADC인 T-DM1은 EMILIA 연구를 기반으로 HER2 양성 전이성 유방암 환자의 2차 치료제로 인정받았다(7). T-DM1의 mPFS는 9.6개월, mOS는 30.9개월로, 당시 표준요법인 Lapatinib+Capecitabine 병용요법의 6.4개월, 25.1개월에 비해 유의한 연장 효과를 나타냈다. 하지만 3등급 이상의 이상반응이 전체 환자의 절반 가량에서 발생하였고, 특히 아시아 환자에서 3등급 이상의 혈소판 감소증의 빈도가 증가하는 양상을 보였다.
이에 아시아 환자를 대상으로 안전성 프로파일을 규명하기 위한 KAMILLA 임상 4상이 수행되었다(8). 이 연구에서 T-DM1군의 mPFS는 5.7개월이었고 3등급 이상의 혈소판감소증 발생률이 44.7%로 나타났으며 임상시험 진행 당시 혈소판감소증 회복 지연으로 인해 6주 이상 약제를 휴약해야 하는 환자들이 있어 계획된 용량보다 용량 강도가 낮아진 문제점이 있었다.
T-DXd (엔허투®)는 일본에서 처음 개발되었고 한국이 적극적으로 임상에 참여하면서 DESTINY 연구에 한국 의료진이 중추적인 역할을 했다. T-DM1과의 차별점은 새로운 기전의 페이로드 사용에 있다(9-13).
T-DM1은 미세소관 저해제(microtubule inhibitor)를 페이로드로 사용하고 있어 비슷한 작용기전을 가진 1차 치료제인 taxane에 대한 내성이 있는 경우 효과가 제한적인 반면, T-DXd는 topoisomerase-1 inhibitor를 페이로드로 가진 약제로 taxane과 다른 항암 작용을 가지고 있어서 taxane에 대한 내성 극복에 도움이 될 수 있다.
또한 세포막을 쉽게 투과할 수 있는 성질을 가지고 있어 표적 단백질의 발현이 낮은 인접한 종양 세포까지 사멸을 유도할 수 있는 bystander 효과가 더 명확하게 나타날 수 있다는 장점이 있다.
이와 함께 항체당 얼마나 많은 약물이 결합할 수 있는지를 나타내는 약물·항체 비율이 T-Dxd는 8:1로, 3.5:1인 T-DM1에 비해 표적 세포에 더 많은 약물을 전달할 수 있다. 종양 선택적 절단 가능한 링커(tumor-selective cleavable linker)를 사용한 것도 특이점이다<그림 1>.
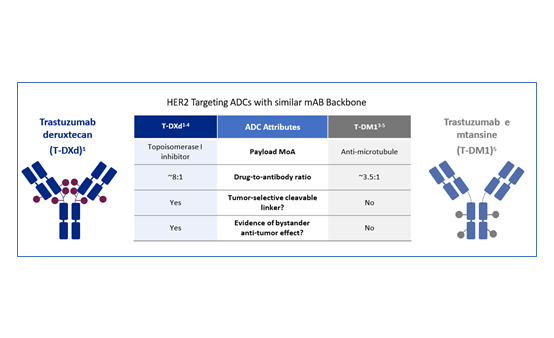
Tucatinib이나 neratinib을 사용할 수 없고 보험급여로 T-DXd를 사용하지 못하는 현 국내 상황에서는 2차 치료로 T-DM1을 사용 후 3차 치료로 T-DXd의 사용도 고려할 수 있다. 또한 안정된 뇌전이가 있는 환자에서도 중추신경계(central nervous system, CNS) 활성도가 높은 T-DXd를 고려하는 것이 더 효과적이고, 글로벌 임상시험에서 생존기간을 연장한 T-DXd가 2차 치료제로 급여가 되어 환자들이 실제로 이익을 받을 수 있는 날이 오기를 기대한다.
ESMO 가이드라인은 T-DXd를 2차 치료로 권고했고(14), NCCN 가이드라인에서 역시 2차 치료로 우선적으로 권고했다(Category 1, preferred) (15). 또한 고무적인 DB-03 및 DB-02 연구 결과를 토대로 한국 의료진 주도로 범아시아 가이드라인(The Pan-Asian Guidelines Adaptation, PAGA)이 업데이트 되었는데 ESMO 가이드라인보다 선제적으로 국소 치료가 필요하지 않은 활동성 뇌전이 환자에서 T-DXd를 사용할 수 있고 (II, A; ESCAT I-A), 뇌전이가 안정적이면 T-DXd를 우선적으로 고려할 수 있다고 권고했다(I, A; ESCAT 1-A, preferred).
Preferred later line and beyond regimen
Tucatinib은 HER2 선택적 TKI로, 다른 HER family를 제외한 HER2에서 매우 낮은 inhibitory concentration 50 (IC50)를 보이며 혈관뇌장벽 통과가 용이하도록 고안됐다(16).
HER2CLIMB 연구에서 표준요법 trastuzumab+capecitabine 병용요법에 tucatinib 또는 위약을 추가하여 비교한 결과, trastuzumab+capecitabine+tucatinib 치료군의 PFS와 OS는 각각 7.8개월, 21.9개월로 대조군의 5.6개월, 17.4개월 대비 유의하게 연장됐다(17).
T-DXd는 tucatinib과 유사한 두개내 반응을 나타내 DB-03 연구에 대한 탐색적 분석을 수행하게 되었다. 기저시점에 안정적인 뇌전이가 확인되고 국소 치료가 요구되지 않은 환자에서 T-DXd 치료군의 mPFS는 15개월로 T-DM1 치료군의 3개월과 큰 차이를 나타냈다. T-DXd 치료군의 완전반응(complete response, CR)은 27.8%, 질병진행(progressive disease, PD)은 2.8%인 반면 T-DM1 치료군은 각각 2.8%과 22.2%로 두개내 반응률 역시 큰 차이를 보였다(18).
Future: New therapy on the horizon
Trastuzumab duocarmazine은 새로운 HER2 표적 ADC로 연구가 진행 중이다(19). TULIP 연구는 trastuzumab duocarmazine과 표준요법을 비교한 연구로 PFS의 중앙값은 각각 6.9개월, 4.6개월로 유의한 차이를 보였다(20). 그러나 T-DXd와 같이 대조군에 비해 크게 개선된 양상을 보이지 않아 T-DXd에 비해 유효성이 낮을 것이라는 애초 연구진의 예상을 빗나가지 않았다.
현재 ZW25, ZW49 이외에 여러 가지 약제가 개발되고 있고, 면역항암제와 방사선 치료, ADC, dual blockade, triple blockade까지 연구가 진행되고 있어 전이성 HER2 양성 유방암 치료 선택의 폭이 한층 넓어질 것으로 전망하며, 환자의 상태에 따른 적절한 치료 방법을 선택할 수 있도록 해야 할 것이다.
ENHERTU®, The next chapter of HER2+ mBC treatment: PART 1

연자 이근석 교수 (국립암센터 혈액종양내과 )
“광범위한 치료를 받은 3차 이상의 환자에서 지속적인 반응률과 생존기간을 입증하며 전이성 HER2 양성 유방암의 새로운 표준 치료 옵션 제시”
DESTINY-Breast01
T-DXd은 DB-01 연구를 통해 HER2 양성 전이성 유방암 3차 이상 환자에서 지속적이고 일관된 항종양 효과를 확인하며 새로운 표준 치료 옵션임을 입증했다(21). DB-01 연구는 이전에 T-DM1을 포함한 두 가지 이상의 항 HER2 기반의 요법을 투여 받은 절제 불가능한 또는 전이성 HER2 양성 유방암 환자 184명을 대상으로 글로벌, 오픈라벨, 단일군, 다기관, 2상으로 진행됐다.
임상에 참여한 환자 비율이 유럽 다음으로 아시아에서 높았고(각각 37%, 34%), 아시안 환자 중 한국인이 40명으로 일본보다 많았다. 이들 중 11명이 2018년 첫 환자 등록 시점부터 현재까지 치료를 지속하고 있어 T-DXd의 장기적인 임상 효과를 확인할 수 있다.
용량결정 연구를 통해 5.4 mg/kg 용량의 T-DXd를 투여했고 환자의 83%가 HER2 IHC(immunohistochemistry) 3+이며, 뇌전이 환자 13%가 포함되었다. 특히 이전 치료 차수 중앙값이 6회로 이미 다수의 치료를 받은 위중한 환자들이 대다수였다. 이전 항암치료로 trastuzumab 또는 T-DM1을 사용했던 비율은 100%, pertuzumab을 사용했던 비율은 65.8%였다.
DB-01은 3번의 데이터 컷오프 (data cut-off, DCO)를 거쳐 분석이 되었다. 2021년 3월 DCO 기준 분석 결과에 따르면 T-DXd는 62%의 객관적 반응률(objective response rate, ORR)을 보이며 18.2개월(median duration of response, mDOR; 95% CI, 15.0-NE)동안 반응이 지속되었으며, mPFS 19.4개월(95% CI, 14.1-25.0)과 mOS 29.1개월(95% CI, 24.6-36.1)을 나타내며 임상적 유효성을 입증했다. 일부 환자에서 5등급 간질성 폐질환(interstitial lung disease, ILD)이 발생했으나, 지속적인 관찰연구에서 3등급 이상의 ILD/폐렴 사례가 추가로 보고된 사례는 없었다.
특히 주목할만한 하위그룹 분석은 24명의 CNS 환자에 대한 분석이다. 기 치료된 안정형 뇌전이 환자에서 58.3%의 confirmed ORR과 mPFS 18.1개월(95% CI, 6.7-18.1)을 보이며 전체 환자군과 비교 시 유사한 임상 결과를 나타냈다. 이는 T-DXd가 뇌전이 환자에서 효과적인 치료 옵션이 될 수 있음을 시사한다(22).
DESTINY-Breast02
DB-02 연구는 3상, 오픈라벨, 다기관 연구로 T-DM1 치료 경험이 있는 절제 불가능한 또는 전이성 HER2 양성 유방암 환자를 대상으로 T-DXd 5.4 mg/kg 치료군 406명과 capecitabine+trastuzumab 또는 capecitabine+lapatinib(Treatment of physician’s choice, TPC) 치료군 202명을 2:1로 무작위 배정했다(23).
연구 결과, 1차 평가변수인 독립적 중앙 맹검 평가(Blinded Independent Central Review, BICR)에 의한 T-DXd의 mPFS는 17.8개월(95% CI, 14.3-20.8)로 TPC (6.9개월; 95% CI, 5.5-8.4)에 비해 유의하게 높았고<그림 2>, 하위그룹에서도 일관된 PFS 개선 효과를 보였다. 또한, 39.2개월에 육박하는 OS 값을 기록하고 (vs 26.5개월; 95% CI, 32.7-NE) T-DM1에 비해 2배 이상 높은 confirmed ORR을 보였다 (69.7%; 95% CI, 65.0-74.1 vs 29.2%; 95% CI, 23.0-36.0).
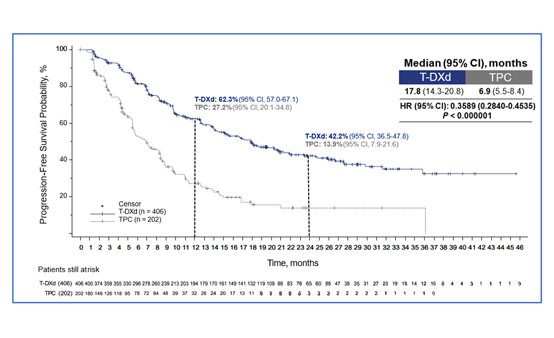
DB-02 3상 임상을 통해 T-DXd는 이전에 T-DM1으로 치료받은 HER2 양성 전이성 유방암 환자에서 TPC 치료군에 대비 PFS와 OS의 유의한 개선 효과를 입증하며 DB-01 2상에서 보여준 임상적 유효성을 확증했다. 이러한 임상시험에 근거해 광범위한 치료를 받은 3차 이상의 환자에서 T-DXd가 새로운 표준 치료 요법으로서 자리매김할 수 있으리라 기대한다.
ENHERTU®, The next chapter of HER2+ mBC treatment: PART 2

연자 Dr. Javier Cortés (International Breast Cancer Center)
“T-DM1 대비 유의미한 생존 기간 개선을 보여
HER2 양성 전이성 유방암 2차 치료의 표준 치료제로서의 근거 뒷받침”
DESTINY-Breast03
DB-03 임상 연구는 오픈라벨, 무작위 대조시험, 다기관 연구로 이전에 trastuzumab과 taxane 계열 항암요법으로 치료받은 절제가 불가능한 또는 HER2 양성 전이성 유방암 환자 524명을 대상으로 T-DXd를 T-DM1과 직접 비교한 3상 임상이다(24). 1차 평가변수는 BICR에 의한 PFS였고, 2차 평가변수로 OS, DOR, 연구자가 평가한 ORR 및 PFS와 안전성을 평가했다.
2021년 유럽종양학회 연례학술대회(European Society of Medical Oncology, ESMO)에서 공개된 DB-03의 첫 중간 분석 결과, T-DM1와 비교한 T-DXd의 PFS 위험비(Hazard ratio, HR)는 0.28로, T-DXd 대비 질병 진행 및 사망 위험을 72% 감소시킨 결과를 보였다 (HR=0.28; 95% CI, 0.22-0.37; p<0.001). 또, 이전에 치료받은 이력이 있는 안정형(stable) 뇌전이 환자를 포함한 모든 하위 그룹에서 T-DM1 대비 유의한 PFS 개선을 입증했다.
지난 2022년 샌안토니오 유방암 심포지엄 (San Antonio Breast Cancer Symposium, SABCS)에서 발표된 DB-03의 OS 추가 분석 결과(2022년 7월, DCO)에 따르면, T-DM1의 mPFS는 6.8개월(95% CI, 5.6-8.2)인 반면, T-DXd는 28.8개월(95% CI, 22.4-37.9)로 T-DM1에 비해 4배이상 연장된 결과를 나타냈다<그림 3>. 추가로, 연구자가 평가한 mPFS는 T-DXd는 29.1개월(95% CI, 23.7-NE), T-DM1은 7.2개월(95% CI, 6.8-8.3)이었다. .
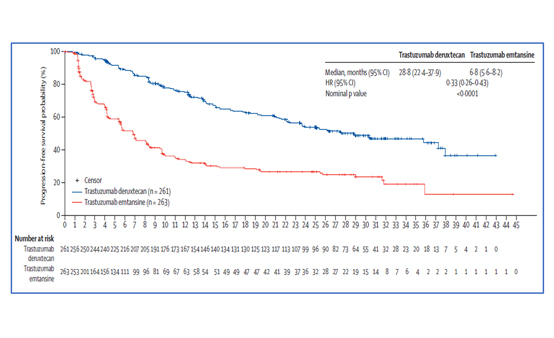
BICR에 의한 ORR의 경우 T-DXd는 79% (95% CI, 73.1-83.4)로 T-DM1의 35% (95% CI, 29.2-41.1)에 비해 두 배 이상 높았다. 또한 T-DXd는 T-DM1에 비해 사망 위험을 36% 감소시키며(HR=0.64; 95% CI, 0.47-0.87; p=0.0037) 통계적으로 유의미한 생존 개선 효과를 확인했다.
기존 2차 표준치료제인 T-DM1와의 직접 비교를 통해 2년을 초과한 우월한 PFS와 유의미한 OS 개선 효과를 보여준 T-DXd는 HER2 양성 전이성 유방암의 차세대 2차 표준치료제 옵션임을 입증했다.
Building confidence in the safe use of ENHERTU®

연자 정경해 교수(서울아산병원 종양내과)
“T-DXd 투여 시 면밀한 관찰을 통한 효과적인 이상반응 관리가 생존율 향상의 핵심”
표적치료제 개발로 암환자의 생존율 증가와 동시에 낮은 독성을 기대하였으나, 일부 환자는 이상반응으로 인해 치료를 중단하기도 한다. 따라서 환자의 투약 순응도를 최대화하며 약제의 효용성을 유지하기 위한 부작용 관리가 생존율 향상 기여에 중요한 부분이 되었다.
Management strategies for common adverse reactions
절제 불가능한 또는 전이성 유방암 환자 257명을 대상으로 T-DXd를 투여한 DB-03 연구의 첫 분석 (DCO, 2021년 5월)에서 T-DXd 치료를 일시 중단하게 한 이상반응은 34%였고, 용량 감소로 이어진 경우는 20%였다. 11%의 환자가 치료를 중단했고, 이 중 8%에서 ILD가 발생했다(26). 20% 이상 보고된 모든 등급의 주요 이상사례는 오심 77%, 빈혈 37%, 호중구감소증 30.7% 등이었고, T-DM1군과 유의한 차이가 없어 T-DXd의 양호한 안전성 프로파일을 확인했다(24).
NCCN 가이드라인에 따르면 T-DXd는 구토 유발 고위험군 약물로 분류되고(15), NK1 (neurokinin-1) 수용체 길항제, 5-HT3 (serotonin) 수용체 길항제, dexamethasone과 olanzapine 등을 사용하여 중재할 수 있다. 1주 이내 회복 시 기존 용량으로, 1주 이후 회복 시 한 단계 낮춘 용량으로 치료를 재개할 수 있으므로 T-DXd의 첫 투여 시부터 적극적인 중재가 필요하다(25).
3등급 이상 호중구감소증 발생 시 2등급 이하가 될 때까지 T-DXd 치료를 일시 중단하고, 3등급에서 회복된 경우 기존 용량으로, 4등급에서 회복된 경우 한 단계 낮춘 용량으로 치료를 다시 시작한다. 혈소판감소증은 3등급 발생 시 1등급까지 회복된 뒤 치료를 다시 시작해야 하고, 4등급 발생 시 또는 7일 내 1등급까지 회복되지 않은 3등급의 경우에는 1등급까지 회복된 뒤 한 단계 낮춘 용량으로 치료를 재개한다.
Management strategies for ILD/pneumonitis
T-DXd 치료를 받은 1,150명의 환자를 통합분석 (DCO, 2022년 12월)한 결과, 유방암 환자는 44.3%가 포함되었고, 이전 약물 치료 차수의 중앙값은 4건, 6.4 mg/kg을 투여받은 환자가 70.3%였다. T-DXd 5.4 mg/kg을 투여 받은 HER2 양성 유방암 환자군 245명 중 16.3%에서 ILD/폐렴(pneumonitis)이 발생하였고, 이 중 77%가 1-2등급의 이상반응이었다. ILD가 발생하는 최초 시기의 중앙값은 치료 시작 후 5.4 (<0.1-46.8)개월이었고, 87%가 1년 이내에 발생하며, 그 이후 발생률에는 큰 차이가 없었다<그림 4>, (26).
ILD 발생 관련 위험인자로 연령(65세 이하), 인종(일본), 동반 폐질환, 신기능 저하(creatinine clearance, CrCl 30 ml/min 이하), 유병기간(4년 이상), 고용량(6.4 mg/kg 초과), 산소 포화도(95% 미만)가 포함되었다(26).
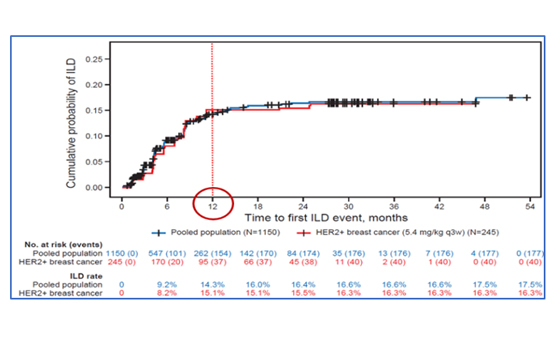
ILD/폐렴과 관련된 증상은 기침, 발열, 호흡곤란, 기저증상의 악화이므로(27), T-DXd 치료 중 관련된 증상을 면밀하게 모니터링하여 ILD 발생이 의심되거나 확인되면 치료를 일시 또는 영구 중단하고 가능한 빨리 전신 스테로이드 치료를 시작해야 한다.
증상 없이 영상 검사에서의 변화가 확인되는 경우 1등급, 증상과 영상 검사의 이상이 확인되면 2등급, 심한 증상이 확인되면 3등급으로 ILD를 분류할 수 있다(29). 일단 ILD나 폐렴이 의심되면 T-DXd를 중단하고 증상의 변화를 확인한 뒤 영상검사, 배양검사, 기관지내시경 및 기관지폐포세척술(bronchoalveolar lavage, BAL)검사를 권고한다(29). ILD 1등급은 치료 중단 후 4주 이내 호전 시 이전 용량으로 치료를 재개할 수 있지만 2등급 이상은 치료를 영구 중단해야 한다.
따라서 환자를 주 1회 이상 추적 관찰하고, 약물로 인한 ILD가 의심된다면 1등급은 스테로이드 0.5 mg/kg로, 2등급 이상에서 steroid 1 mg/kg으로 투여를 시작하는 것을 권고한다. ILD 등 이상 반응이 나타나면 고용량 스테로이드 치료 및 약물 치료 중단 등에 대한 부담이 있으므로 부작용에 대한 철저한 환자 교육, 다학제간 진료 협력 등을 통해 효과적으로 이상반응을 관리하는 것이 치료 효과를 개선시키는데 도움이 될 것이다(29).
Q&A
Q1. T-DXd 투여가 간기능 검사 수치 악화, 간경병증(liver cirrhosis) 등 간기능 저하와 연관이 있다고 보십니까?
T-DXd는 간에서 대사되기 때문에 간기능 검사 수치 악화가 일어날 수 있습니다. 간전이를 동반한 환자에서 화생(metaplasia)으로 섬유화(fibrosis) 되면서 문맥압항진증이 발생하여 복수 등의 합병증을 나타낼 가능성도 있으나 이는 매우 드문 경우라고 할 수 있습니다. 다만, 과거 B형 간염을 앓았었으나 잘 회복되었던 환자 (HBsAg/sAb -/+, HBcIgG +, HBcIgM -) 에서 T-DXd를 사용하고 간기능 수치 악화가 있었던 증례도 있으므로, 주의가 필요합니다. 그렇지만, HBcIgG(+) 소견만으로는 T-DXd 사용 전 anti-viral prophylaxis가 권유되지 않는다는 점을 참고하십시오.
T-DM1를 투약한 경우 특발성 문맥압 항진증(non-cirrhotic portal hypertension)이 발생한다는 후향적 연구가 있습니다(30). 반면 짧은 개인적인 경험으로는 T-DXd 투여 시 간경변으로 진행된 케이스는 아직까지는 없었습니다
Q2. 고용량 스테로이드를 투약하고 있는 림프관성 폐 전이를 동반한 뇌전이 환자에게 T-DXd 사용 시 독성 가이드라인에 맞춰서 투여하는 것이 쉽지는 않은 것 같습니다. 임상에서 어떻게 관리하고 계신지요?
T-DXd 투여는 다른 항암제에 비해 면밀한 모니터링이 필요합니다. 림프관성 폐전이는 감염 또는 ILD와 감별 진단이 어려운 경우가 있습니다. 이러한 경우 암 자체보다 감염 또는 ILD가 더 위험할 수 있으므로 이들의 감별을 위해 다학제 진료가 중요하며 신속히 기관지내시경 및 BAL을 시행하고, 검사 결과가 나오기 전까지 감염과 ILD에 준해 경험적 항생제와 스테로이드를 함께 투여하게 됩니다.
ILD로 인해 치료를 중단하였다가 문제가 해결된 후 다시 치료를 시작한 47명의 환자 중 3명에서만 ILD가 재발한 것으로 보고됐습니다. 치료 재개 시 ILD가 빈번하게 생기지는 않았다는 사실은 ILD에 대한 면밀한 모니터링과 즉각적인 진단, 적절한 관리가 무엇보다 중요하다는 점을 시사합니다.
Closing remarks
좌장 (박연희 교수): HER2 양성 전이성 유방암 치료에서 ‘전례 없는 데이터’를 보여준 엔허투는 5만 명이 넘는 국민청원으로 허가를 획득한 첫 번째 약제이며, 급여 적용을 위한 국민청원이 다시 한번 5만 명을 넘어섰습니다. 이런 의미에서 엔허투는 환자들에게 빚진 셈입니다.
하루라도 속히 급여가 적용되어 유방암 환자들에게 삶의 질 향상과 생존 연장으로 보답할 날이 앞당겨지기를 고대합니다.
References
1. Marchiò, Caterina, et al. "Evolving concepts in HER2 evaluation in breast cancer: Heterogeneity, HER2-low carcinomas and beyond." Seminars in cancer biology. Vol. 72. Academic Press, 2021.
2. Baselga, José, et al. "Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer." New England Journal of Medicine 366.2 (2012): 109-119.
3. Swain, Sandra M., et al. "Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer." New England journal of medicine 372.8 (2015): 724-734.
4. Miles D et al, Ann of Oncol 2021
5. Rimawi, Mothaffar, et al. "First-line trastuzumab plus an aromatase inhibitor, with or without pertuzumab, in human epidermal growth factor receptor 2–positive and hormone receptor–positive metastatic or locally advanced breast cancer (PERTAIN): A randomized, open-label phase II trial." Journal of Clinical Oncology 36.28 (2018): 2826-2835.
6. Arpino J et al, SABC 2020
7. Verma, Sunil, et al. "Trastuzumab emtansine for HER2-positive advanced breast cancer." New England journal of medicine 367.19 (2012): 1783-1791.
8. Wuerstlein, R., et al. "Final results of the global and Asia cohorts of KAMILLA, a phase IIIB safety trial of trastuzumab emtansine in patients with HER2-positive advanced breast cancer." ESMO open 7.5 (2022): 100561.
9. Nakada, Takashi, et al. "The latest research and development into the antibody–drug conjugate,[fam-] trastuzumab deruxtecan (DS-8201a), for HER2 cancer therapy." Chemical and Pharmaceutical Bulletin 67.3 (2019): 173-185.
10. Ogitani, Yusuke, et al. "DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1Preclinical Efficacy of DS-8201a, a Novel HER2-Targeting ADC." Clinical Cancer Research 22.20 (2016): 5097-5108.
11. Trail, Pamela A., Gene M. Dubowchik, and Timothy B. Lowinger. "Antibody drug conjugates for treatment of breast cancer: novel targets and diverse approaches in ADC design." Pharmacology & therapeutics 181 (2018): 126-142.
12. Ogitani, Yusuke, et al. "Bystander killing effect of DS‐8201a, a novel anti‐human epidermal growth factor receptor 2 antibody–drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity." Cancer science 107.7 (2016): 1039-1046.
13. LoRusso, Patricia M., et al. "Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2–positive cancer." Clinical Cancer Research 17.20 (2011): 6437-6447.
14. Gennari, Alessandra, et al. "ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer☆." Annals of oncology 32.12 (2021): 1475-1495.
15. NCCN Clinical Practice Guidelines in Oncology for Breast Cancer. V.2. 2023
16. Courtesy of Lin N, SABC 2019
17. Murthy, Rashmi K., et al. "Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer." New England Journal of Medicine 382.7 (2020): 597-609.
18. Hurvitz SA et al. Presented at: San Antonio Breast Cancer Symposium 2021; December 7-10, 2021; San Antonio, TX, USA. Presentation GS3-01.
19. van der Lee, Miranda MC, et al. "The preclinical profile of the duocarmycin-based HER2-targeting ADC SYD985 predicts for clinical benefit in low HER2-expressing breast cancers." Molecular cancer therapeutics 14.3 (2015): 692-703.
20. Saura C, ESMO 2021
21. Hurvitz, S. A. "SABCS 2022 Presentation Materials."
22. Jerusalem G, et al. ESMO Breast Cancer 2020. Abstract 715.
23. San Antonio Breast Cancer Symposium – December 6-10, 2022.
24. Hurvitz, Sara A., et al. "Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial." The Lancet 401.10371 (2023): 105-117.
25. Data on file. Daiichi Sankyo, Inc., Basking Ridge, NJ.
26. Powell, C. A., et al. "Pooled analysis of drug-related interstitial lung disease and/or pneumonitis in nine trastuzumab deruxtecan monotherapy studies." ESMO open 7.4 (2022): 100554.
27. Schraufnagel, Dean E., ed. Breathing in America: diseases, progress, and hope. American Thoracic Society, 2010.
28. Common Terminology Criteria for Adverse Events (CTCAE) v5.0. 2017.
29. Li BT, et al. Article and supplementary appendix. N Engl J Med. 2021
30. Choi, Se Jin, et al. "Noncirrhotic Portal Hypertension after Trastuzumab Emtansine in HER2-positive Breast Cancer as Determined by Deep Learning–measured Spleen Volume at CT." Radiology 305.3 (2022): 606-613.

