제57차 유럽 신장-투석 및 이식 학회 연례학술대회(ERA-EDTA 2021)가 2021년 6월 5~8일 온라인으로 개최됐다. 새틀라이트 심포지엄에서 'Microbiome in CKD'를 주제로 Carmela Cosola 교수(University of Bari Aldo Moro, Italy), Alessandra Perna 교수(University of Campania Luigi Vanvitelli, Italy)가 강연을 발표했고, 'Uraemic toxicities'를 주제로 Lucie Henaut 교수(University of Picardy Jules Verne, France)가 발표했다. 본지는 이날의 강연 내용을 요약 정리했다.
만성신장질환(chronic kidney disease, CKD)에서 장내 미생물총을 표적한 치료 전략이 주목받고 있다. CKD 환자의 장내 미생물총은 장내균에서 유래한 indoxyl sulfate, p-cresyl sulfate와 같은 요독소(uremic toxin) 생성을 촉진하는 단백질 분해 세균은 증가해 있고, 단쇄지방산을 생성하는 Prevotellaceae, Lactobacillaceae와 같은 당화성세균(saccharolytic bacteria)은 감소해 있는 불균형 상태인 것으로 알려져 있다. 이러한 장내 세균총 조성의 변화로 인해 장벽의 투과성이 높아지고 요독증이 악화될 수 있다. 특히 CKD 치료에서 적용되는 식이제한 요법과 약물요법은 장내 미생물총의 불균형을 초래하여 장 투과성과 변비 등을 악화시키는 데 기여하는 것으로 보고되어 있다. CKD 환자에서 흔히 나타나는 변비는 중요한 적응증 중 하나이며 식이요법과 약물요법에 의해 상당히 영향받는 질환이다. 변비는 장내 미생물총 조성의 변화가 임상적으로 나타나는 증상으로, 장내 미생물총의 불균형과 밀접한 연관성을 가진다. 변비와 요독소 생성은 서로 연관되어 있으며 악순환의 고리로 엮여져 있다. In vitro 연구에서 요독소인 indoxyl sulfate, p-cresyl sulfate 등이 대장의 최대 수축력을 유의하게 감소시키는 것으로 확인했다. 장 운동성도 변비에 중요한 역할을 한다. CKD 변비 환자에서 대장 통과가 정체되면서 단백질 분해 방향으로 대사 전환이 발생한다. 그에 따라 아미노산 이용성은 증가하고 당분해성 기질 이용성은 감소되면서 요독소 생성이 증가하는 악순환이 발생한다. 최근 미국 3,500만 명의 재향군인을 대상으로 한 역학 조사에 의하면 변비는 비신장질환 환자군 및 CKD 환자군에서 모두 심혈관계질환의 위험을 높이는 인자이다. 실제로 심각한 변비는 건강한 정상인에서 심혈관계 사건 발생 위험을 23% 높이는 것으로 보고되어 있다. 특히, 본 연구진은 CKD에서 전형적인 심혈관계 위험인자로 알려진 PCS, IS, TMAO, indole acetic acid와 같은 장 유래 요독소의 중요성에 주목했다. 앞서 언급한 바와 같이 변비 증상이 심각할수록 요독소가 더 많이 축적된다. 이에 따라 요독소 또는 세균 유래 물질에 의해 유도되는 염증성 메커니즘을 통해 변비가 동맥경화 발생 기전에 관여할 것으로 추정한다. 최근 3-4기 CKD 환자를 대상으로 한 무작위 pilot 임상에서 Lactobacilli, Bifidobacteriaceae가 풍부한 공생균 제제를 투여했을 때 유리 indoxyl sulfate 등의 요독소가 감소함을 관찰했다. 소장의 투과성 감소와 더불어 변비 증상의 개선도 나타났다. 즉, 장내 미생물총의 불균형과 장 투과성, 변비, 세 가지 요인 간의 유의한 삼각관계를 확인한 셈이다<그림 1>.
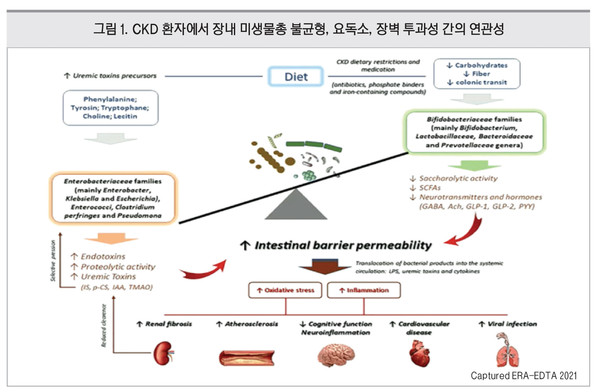
CKD 환자에서 장을 목표로 하는 치료 전략은 장내 미생물총 균형을 조절하여 변비를 치료하고 염증을 줄이는 관점에서 접근할 필요성이 있다. 또한 환자의 임상적인 상태에 따라 식이, 보충제, 약제 등 개인별 맞춤화된 치료 전략이 요구된다.
CKD 환자에서 황화수소 대사에 관여하는 cystathionine gamma-lyase 효소의 활성을 요독소가 저해하기 때문인 것으로 추정한다. 황화수소 생성 시 부산물로 동반되는 요독소인 란티오닌(lanthionine)에 대해서도 주목할 필요가 있다.
CKD의 최악의 시나리오는 바로 요독증이다. 요독소는 요독증의 주요 원인으로, 독성학의 정의에 따르면 화학적 또는 미생물학적 물질로 생물체에서 반응을 유도하고, 그 반응이 인체에 유해한 영향을 미칠 때 그 물질을 요독소로 간주한다. CKD 환자의 장내 미생물총의 특성과 요독소의 역할 및 다양한 요독소에 대해 살펴보겠다. CKD 환자에서는 장내 미생물총의 변화가 나타난다. CKD 환자에서 장내 미생물총은 다양한 종이 고르고 복잡하게 존재하는 정상 상태와는 달리 미생물총이 단순화되고 특정 종이 우위를 점유하는 상태로 변형되어 있다. 혈중 요소 농도가 높은 상태에서, 장관 내로 요소가 유입되면 urease 생성균에 의해 요소는 암모니아와 암모늄수산화물로 전환된다. 이는 장 상피세포의 연결을 파괴하여 내독소(endotoxin) 유입에 의한 내독소혈증(endotoxemia), 결국 전신 염증 상태까지 유발할 수 있다. 대부분이 단백질 결합형으로 존재하는 요독소는 대개 쉽게 투석되지 않기 때문에 자유형으로 존재하는 요독소가 더 중요한 역할을 한다. 또한 CKD 환자에서 잔여 신기능, 세뇨관 분비 및 청소율의 정도가 중요한 역할을 한다. 그 예로 자유형 p-cresyl sulfate는 CKD 환자에서 심혈관계 변수와 가장 밀접한 연관을 보이는 종류의 요독소로 보고된 바 있다. 상대적으로 덜 밝혀져 있는 황 화합물에 대해서도 살펴볼 필요가 있다. 황화물은 체내에서 내인성으로 발생하는 기체라는 점이 몇 년 전 밝혀진 바 있다. 실제로 황화물은 일산화질소(NO), 일산화탄소(CO) 다음으로 세 번째로 생성된 기체신호전달물질(gasotransmitter)로 생물학적으로 유효한 속성을 나타낸다. 불과 얼마 전까지만 해도 황화물은 단지 몇몇 음식물로부터 생성되는 환경 독소로 이해되어 왔다. 황화수소는 생리적으로 다양한 역할을 하는데 혈관의 이완에도 관여할 뿐만 아니라 심혈관계와 중추신경계에서 세포보호작용을 나타내며, 산화스트레스와 세포사멸을 감소시키는 작용을 나타낸다. 황화수소의 50%는 미생물총에서 생성된다. 그런데 투석 환자의 혈액 및 신장 실질 조직에서 황화수소의 수치는 모두 낮았다. CKD 병기가 진행됨에 따라 유의하게 황화수소가 감소하였고, 사구체여과율과도 연관성을 보였다. CKD 환자에서 황화수소 대사에 관여하는 cystathionine gamma-lyase 효소의 활성을 요독소가 저해하기 때문인 것으로 추정한다. 황화수소 생성 시 부산물로 동반되는 요독소인 란티오닌(lanthionine)에 대해서도 주목할 필요가 있다. 투석 환자에서 란티오닌 수치가 대조군 대비 훨씬 증가되어 있음을 발견했다. 란티오닌은 단백질을 형성하지 않는 황 함유 아미노산으로 세균에 의해 합성된다. 란티오닌은 황화수소 합성을 감소시키고 세포 내 칼슘 수치를 증가시킨다. 란티오닌이 장내 미생물 환경에서 어떠한 기전으로 생성되는지에 관해서는 추가 연구가 필요하다. 란티오닌 역시 미생물에서 유래된 물질이나 장내 미생물총 수준에서 어떻게 생성되는지에 대해서는 밝혀진 바가 없다. 이러한 의문점에 대한 답을 찾기 위해 본 연구진은 Marie-Curie ITN 프로젝트에 다른 13개 팀과 함께 참여해 재정적 지원을 받고 있다. 향후 수 년 후 이러한 질문들 중 적어도 몇 가지에 대해서는 답할 수 있는 여러 전략들을 모색할 수 있게 되기를 기대한다.
요독소와 대식세포(Uraemic toxins and macrophages)
Lucie Henaut (University of Picardy Jules Verne, France)
요독소가 대식세포 기능에 미치는 영향과 칼슘 석회화 조절 작용과의 연관성에 대한 최신지견을 공유하고자 한다. 심혈관계 세포의 석회화(calcification) 과정에는 유도인자와 억제인자 간의 균형이 중요하다. 유도인자로는 칼슘, 활성산소종(reactive oxygen species, ROS), 염증 상태 등을 꼽을 수 있고, 저해인자로는 pyrophosphate, osteopontin 등이 있다. CKD 환자에서 석회화 유도인자는 증가되어 있고, 억제인자는 감소되어 있어 불균형한 대사 상태를 나타낸다. 대식세포는 표현형에 따라 각기 다른 역할을 한다.M1 대식세포는 유도인자를 분비하며 골형성 표현형으로 전환하여 석회화를 유도한다. 반면, M2 대식세포는 항염증성 특징을 나타내 골형성 표현형으로의 전환을 저해하고 석회화를 감소시키는 역할을 한다. 요컨대 석회화는 유도인자-억제인자 간 균형뿐만 아니라 대식세포의 표현형 간 균형에 의해서도 영향을 받는다<그림 2>.

그렇다면 요독소는 대식세포의 표현형에 어떠한 영향을 미치는 것일까? 2015년 Matsuo 연구진은 THP-1 세포에 indoxyl sulfate 투여 시 활성산소종과 염증성 사이토카인의 유의한 증가를 보고했다. 2019년 Circulation 저널에서는 indoxyl sulfate를 대식세포에 처리한 후 30분 만에 Notch 수용체의 리간드인 DLL-4 단백질 발현이 촉진됨을 보고했다. 이 때 CKD 마우스 모델에서 DLL-4 항체를 투여했을 때 심혈관계 세포의 골 형성 표현형으로의 전환이 유의하게 감소했다. Indoxyl sulfate 유도성 염증과 석회화 유발 효과 간의 직접적인 연결고리를 최초로 입증한 연구라고 할 수 있다. 본 연구진은 요독증이 대식세포가 파골세포로 분화하는데 미치는 영향에 대해 광범위하게 연구해 왔다. 그 결과, 요독성 혈청 내 단핵세포(PBMC)는 TRAP+세포를 형성하는 데 필요한 M-CSF, RANKL에 대한 반응성이 감소되어 있었으며 골 흡수가 저하되어 있음을 밝혔다. 이 현상은 인산과 indoxyl sulfate에 모두 의존적이었다. 2012년 Nephrology Dialysis Transplantation에 발표한 연구에서 실제로 인산과 indoxyl sulfate가 시너지 효과를 가지고 파골세포의 분화와 골 흡수 억제를 유의하게 증진시킴을 보고했다. 요독소는 단핵구와 대식세포의 칼슘 감지 수용체 발현을 감소시켜서 석회화를 촉진하는 것으로 추정한다. 정리하자면 요독증은 대식세포의 염증유발성 표현형을 촉진하고 골 흡수를 저하시켜서 대식세포 표현형 간의 불균형을 초래한다. 특히 인산과 indoxyl sulfate는 대식세포에서 파골세포로의 분화 및 골 흡수를 억제하여 석회화를 촉진한다. 향후 대식세포의 본래 생리학적 기능은 유지하되 석회화 유도 효과만을 저해할 수 있는 표적 치료 방안과 비타민D 수용체 효능제, 칼슘 유사체 등의 CKD 치료제의 활용이 과제로 남아있다.
정리 .메디칼라이터부

