종양미세환경의 물리적 강성도 증가에 의한 YAP 발현 조절
미만형 침윤성 위암 새로운 치료 실마리 개발 가능성 기대
[메디칼업저버 정윤식 기자] 연세의대 정재호 교수(위장관외과) 연구팀과 KAIST 김필남·최정균 교수 연구팀이 학제간 융합연구를 통해 종양 미세환경의 물리적 인자(세포기질의 강성도 증가)가 암세포의 악성화를 촉진하는 분자후성유전학적 원인임을 최초로 규명했다.

이번 연구는 향후 미만성 위암에 대한 새로운 항암 치료 전략 수립에 방향을 제시할 중요한 실마리가 될 것으로 기대된다는 게 연구팀의 설명이다.
현재까지 암 연구는 대부분 종양세포 자체의 돌연변이나 내부 신호전달 경로에 집중됐다.
이에 최근 암 면역 치료의 임상적 성공에 힘입어 종양미세환경의 면역 세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료 반응에 어떤 영향을 주는가에 대한 연구는 거의 없던 실정이다.
이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 끼치는 영향을 규명함으로써 종양학 연구의 새로운 패러다임을 제시한 것이 특징이다.
연구팀은 생체 재료를 활용해 인간의 종양미세환경과 유사한 위암 실험 모델을 개발하고, 이를 이용해 단단해진 종양 기질 미세 환경에 따른 위암 세포의 악성화 메커니즘을 살펴봤다.
종양미세환경이란 종양 내에 존재하는 암세포, 암의 형성 및 진행에 직·간접적으로 영향을 미치는 주변 조직세포(면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 세포외기질물질(Extracellular Matrix)을 총칭한다.
이는 세포와 세포사이를 연결하고 지탱해주는 결합 조직 역할을 하는 물질로, 콜라겐과 같은 단백질이 이에 속한다.
세포외기질은 단순한 지지체가 아니라 이것의 물리적·화학적 특성이 세포의 운명과 특성 등에 직·간접적으로 영향을 미친다.
특히 병적 요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화 원인이 된다고 알려져 있다.
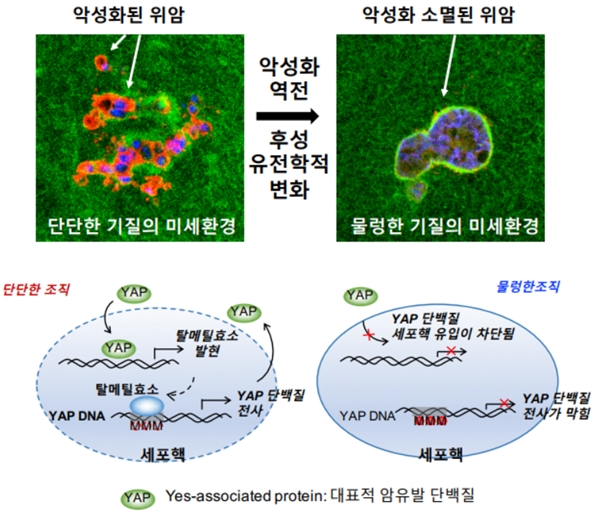
연구 결과, 강성도가 증가된 종양 기질 내에서는 암세포의 후성유전학적 변화가 유도되면서 DNA 탈메틸화가 나타나고 종양 단백질로 잘 알려진 YAP(Yes-associated protein)의 발현이 증가돼 악성화가 촉진되는 것으로 나타났다.
경성 종양 기질에서는 암세포의 YAP 발현량이 물렁한 조직에 비해 평균 7배 이상 증가했다.
반대로 단단하게 변성된 종양 기질을 다시 물렁한 조직으로 변화시킬 경우, 악성화된 위암 세포에서 역전현상이 일어나 침윤과 같은 악성도가 감소되고 항암제에 반응하는 세포로 변화함을 확인했다.
김필남 교수는 이번 연구 성과는 공학적인 기술들을 활용해 인체와 유사한 종양미세환경을 구현하는 암모델을 제작할 수 있기 때문에 가능했던 것이라고 강조했다.
김 교수는 "인체 질병을 모사한 공학적인 기술들은 더 발전될 것"이라며 "이를 이용하게 된다면 '암의 물리적 치료'와 같은 혁신적인 치료법의 개발이 가능할 것"라고 말했다.
정재호 교수도 "치료가 어려운 난치성 미만성 위암의 악성화를 촉진하는 원인을 암세포 자체의 변이가 아닌 종양기질의 물리적 특성과의 상호작용에 기인함을 규명한 최초의 성과"라며 의미를 부여했다.
그는 이어 "임상적으로 가장 어려운 경성암(scirrhous cancer)의 새로운 치료 가능성을 제시해 위암뿐만 아니라 다양한 암종에서 유사한 병태생리적 기전에 의해 발생하는 경성암에 대한 새로운 치료 패러다임을 제시했다"며 "종양 기질을 표적으로 하는 치료법 개발에 기여할 것으로 기대된다"고 덧붙였다.
한편, 이번 연구는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐으며 KAIST 바이오및뇌공학과 장민정 박사가 제1 저자로 참여해 국제학술지 'Nature Biomedical Engineering(IF 18.952)'에 최근 게재됐다.
