아셀렉스-길리어드 아니토캅타진, 임상2상서 카빅티와 비슷한 효능
BCMA 표적 다발골수종 치료제 시장서 카빅티와 경쟁 예고

[메디칼업저버 양영구 기자] 다발골수종 5차 이상 치료옵션에서 새로운 CAR-T 치료제 등장 기대감이 커지고 있다.
현재 다발골수종 5차 이상 치료 환경에서 사용할 수 있는 CAR-T 치료제는 얀센의 BCMA 표적 CAR-T 치료제 카빅티(성분명 실타캅타진 오토류셀)가 있다.
이런 가운데 최근 아셀렉스와 길리어드가 공동 개발한 아니토캅타진 오토류셀이 임상2상에서 긍정적인 결과를 발표하며 뒤를 쫓고 있다.
카빅티, 다발골수종 4차 이상에서 ORR 97%
카빅티는 2022년 미국식품의약국(FDA)으로부터 재발성 또는 불응성 다발골수종 5차 치료옵션으로 허가됐다. 허가의 기반은 임상2상 CARTITUDE-1 연구다.
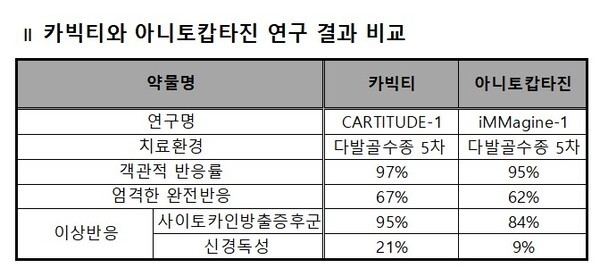
이 연구에서 카빅티는 12.4개월(중앙값) 추적관찰 결과, 객관적 반응률(ORR)은 97%(95% CI 91.2~99.4)를 나타내며 1차 목표점을 충족했다. 이 중 67%는 엄격한 완전반응(sCR)을 보였다.
첫 반응까지의 시간은 1개월이었고, 시간이 지날수록 반응률은 두드러졌다. 반응지속기간(DoR)과 무진행생존(PFS)은 중앙값에 도달하지 않았다.
12개월 PFS는 77%였고, 12개월 전체생존(OS)은 89%로 집계됐다.
CAR-T 치료제 특성상 혈액학적 부작용이 흔했다. 3~4등급 혈액학적 이상반응은 호중구 감소증이 95%로 가장 많았고, 빈혈(68%), 백혈구 감소증(61%), 혈소판 감소증(60%), 림프구 감소증(50%) 순으로 많았다.
특히 사이토카인 방출 증후군은 95%에서 발생했는데, 이 중 3~4등급 사이토카인 방출 증후군은 4%였다. 다만, 5등급 사이토카인 방출 증후군을 보인 1명의 환자를 제외하고는 모두 해소됐다.
신경 독성을 보인 환자는 21%였고, 이 중 3~4등급 신경 독성은 9%였다.
카빅티 쫓는 아니토캅타진
이런 가운데 아니토캅타진 오토류셀이 카빅티의 뒤를 바짝 쫓고 있다.
아니토캅타진 오토류셀은 앞서 3차 치료를 받은 경험이 있는 재발성 또는 불응성 다발골수종 환자를 대상으로 한 임상1상에서 ORR 100%, sCR 76%를 달성한 바 있다. 당시 추정 24개월 PFS는 56%로 집계됐다.
최근 아셀렉스와 길리어드는 아니토캅타진 오토류셀의 임상2상 iMMagine-1 연구 결과를 공개했다.
이 연구는 이전에 4차 치료를 받은 성인 다발골수종 환자 58명이 등록됐다. 이들은 백혈구 채취술과 아니토캅타진 오토류셀 제조 후 림프구 감소 화학요법과 아니토캅타진 오토류셀을 투여 받았다.
10.3개월(중앙값) 추적관찰 결과, 연구자가 평가한 ORR은 95%로 집계됐다. 이들 중 sCR을 달성한 환자 비율은 62%였다. 미세잔존질환(MRD) 평가가 가능한 환자의 92%는 MRD 음성을 달성했다.
6개월 추정 PFS와 OS는 각각 90%, 95%로 집계됐다. PFS와 OS 모두 중앙값에 도달하지 않았다.
3등급 혈액학적 부작용은 호중구 감소증이 62%로 가장 많았고, 혈소판 감소증과 빈혈이 각각 26%로 뒤를 이었다.
사이토카인 방출 증후군이 발생한 환자는 84%였다. 1등급 사이토카인 방출 증후군이 64%로 가장 많았고, 2등급 19%였다. 5등급은 1명에게서 발생했다.
신경 독성은 9%에서 관찰됐다. 이 중 1등급과 2등급은 각각 3%, 3등급이 2%였다. 다만, 뇌신경 마비, 길랭-바레 증후군, 파킨슨병 등은 관찰되지 않았다.
연구팀은 "다발골수종 5차 치료 환경에서 아니토캅타진 오토류셀은 지속적인 효능과 안전성을 입증했다"며 "특히 주목할 점은 신경 독성, 뇌신경 마비, 길랭-바레 증후군, 파킨슨병 등의 증상이 나타나지 않았다는 것"이라고 강조했다.
