제약·바이오업체, RA 전문인력 구하기 하늘의 별 따기
산업 성장하면서 필수인력 됐지만 양성부터 쉽지 않아
식약처, 규제과학 전문인력 교육 사업 6개 기관서 실시

제약사, 의료기기업체, 바이오기업 등에서 개발하는 제품의 인허가 관련 업무를 담당하는 것으로 잘 알려진 'RA(Regulatory Affairs)' 직무. 각 국가별로 정해진 규정 및 제도를 분석·취합해 제품의 허가·변경을 이끌어내는 기술문서 작성을 주요 업무로 하고 있다. 아울러 현행 법령에 의해 필수적으로 제출해야 하는 문서 및 데이터를 토대로 허가당국과 논의하는 역할을 직접 맡기도 한다. 그 중요성만큼이나 많은 수의 RA가 업계에서 활약하고 있을 것 같지만 실상은 그렇지 않다. 절대적인 인력 수가 부족할뿐더러 RA를 양성하는 시스템도 미비하다. 다행인 것은 정부가 규제과학 전문가 육성을 필요성을 깨닫고 본격적인 지원에 나섰다는 것인데 업계에서는 기대와 우려의 시선을 동시에 보내고 있다. 이에 RA 인력의 중요성에 비해 초라한 현 상황을 진단하고 걸음마 단계에서 시작하게 된 전문 인력 육성 계획의 구체적인 내용, 효과적인 운용을 위해 필요한 요소 등을 짚어봤다.
1부: 업계 최전선에 있지만 인력풀은 최후방에 방치…RA 현실은?
2부: 규제과학 인력 양성 사업 실효성 높이려면?…선정기관 인터뷰 등
[메디칼업저버 정윤식 기자] 의약품의 연구, 개발, 사용, 사후관리까지 허가·심사 과정 전주기에 관여하는 인력 'RA(Regulatory Affairs)'의 필요성이 점차 커지고 있다.
RA는 회사를 대표해 식품의약품안전처 등 규제기관 대응의 최전선에 서 있는 가장 중요한 핵심 인력이다.
문제는 RA 전문인력이 턱없이 부족하다는 것인데, 극히 일부 업체를 제외하고 중소형 제약사와 신생 기업은 RA 채용이 '하늘의 별 따기'와 다름없다.
다행히 정부가 인력 육성의 필요성을 인지하고 5개 대학, 1개 기관과 협력해 양성 사업을 계획했지만, 당장 현장에 투입될 인력이 필요한 업계에서는 아직 갈 길이 멀었다는 평가가 지배적이다.
제약 산업 성장할수록 필수불가결한 존재 'RA'
RA는 제약 산업이 성장함에 따라 그 필요성이 함께 높아진 존재다.
과거 제약사들이 제네릭 품목에만 집중하던 시기에는 중요성이 크게 부각되지 않았지만, 신약 개발이 곧 미래 경쟁력이 되는 현 상황에서 RA는 선택이 아닌 필수가 됐다.
즉, 제약 산업이 발전하면서 업체로서는 허가당국을 상대할 일이 더 많아졌고 이와 동시에 넘어야 할 규제 허들도 덩달아 높아지면서 소위 '전문가'가 필요해진 것이다.
이는 제품 개발 전주기에 걸쳐 영향력을 행사하는 RA의 역량이 곧 의약품 허가·사용 속도로 직결되기 때문이다.
때에 따라 비임상시험 단계부터 관여하는 경우도 있긴 하나, RA의 주요 업무는 △임상시험 계획 승인 신청 △신제품 허가 전략 수립 △의약품 품목 허가 신청 △기허가 품목 사후 관리 △규제 규정 변화 분석 △신기술 의약품 안전관리 연구 △국제 지침 이해 및 적용 △대관업무 등 다양하다.
제약업계 A관계자는 "그동안 제네릭은 정형화된 패턴이 있고 허가부터 도입, 사용, 사후관리 등 특별히 어려운 것 없이 규정만 잘 파악해도 특별한 무리가 없었다"며 "하지만 산업 생태계가 다변화되고 신약 개발 등이 더 중요한 시대가 되면서 RA의 전문성이 절실해졌다"고 언급했다.
그는 "과거 제네릭 위주였을 때 우후죽순 제약사들이 생겨났고 벤처 붐이 터지면서 바이오 업체도 어느 순간 폭발적으로 많아졌다"며 "이 모든 기업들이 높아진 업무 난이도와 레벨에 적응해 신제품 서류 등을 들고 식약처와 대등한 위치에서 협의하는 것은 어려울 것"이라고 진단했다.
결국 대형제약사, 중소형업체, 바이오벤처기업 등 너나 할 것 없이 규제과학을 전문으로 하는 RA의 채용 및 운용에 눈길을 돌릴 수밖에 없는 현실이 됐다는 게 이 관계자의 설명이다.
특히, 바이오기업의 경우 제약사에 비해 RA에 채용에 더 골머리를 앓고 있다는 주장이 지배적이다.
바이오업계 B관계자는 "제약사는 조금 상황이 낫다고 본다. 바이오쪽은 규제 관련 업무를 경험한 RA 인력을 구경하기 힘들 정도로 전무하다는 게 가장 심각한 문제이자 시급히 해결해야 할 일"이라며 "결국에는 자체적으로 교육 할 수밖에 없는데 이론적인 내용이 대부분이고 실무경험을 토대로 트레이닝 하는 경우는 거의 없다"고 토로했다.
RA 전문 회사에 외주를 맡기는 방법도 있지만, 이 또한 기본적인 RA 인력조차 없는 업체에게는 큰 효과가 없다는 의견이다.
그는 "외주를 맡긴다고 한들 내부에서 이를 확인하고 판단하는 담당자가 있어야 하는데 그런 인력조차 없다"며 "특히 일부에서는 RA가 규제 및 허가 관련 서류만 정리하는 단순한 일을 한다고 생각해 인사이동 등으로 대체할 수 있다고 착각하기도 한다"고 강조했다.
식약처, 규제과학 인재양성사업 실시
경희대·중앙대·바이오의약품협회 등 참여
RA 등 규제과학 인력의 시급한 공급이 필요하다는 것을 인지한 식약처는 지난달 규제과학 인재양성 사업 운영지침을 마련하고 주관연구 기관 및 대학을 공모했다.
신진연구자 및 현장전문가 양성 교육을 담당할 인재양성대학 5곳과 이 대학들이 우수한 성과를 도출할 수 있도록 사업의 기획·평가·관리 등 컨트롤 타워 역할을 수행할 규제과학 연구지원센터 1곳이 대상이다.
공모 결과 인재양성대학은 경희대학교, 아주대학교, 고려대학교(세종), 중앙대학교가 선정됐으며 연구지원센터는 한국바이오의약품협회가 맡는다.
현재 '의약품 유효성평가(Ⅱ)' 영역을 담당할 1개 대학만 재공모 중이다.
이번 사업은 식약처 '제2차 규제과학 인재양성사업'의 일환이며, 주관연구기관 공모의 경우 '국가연구개발혁신법 시행령(과학기술정보통신부 대통령령 제31297호) 제9조'에 근거해 식품의약품안전평가원이 담당하고 있다.
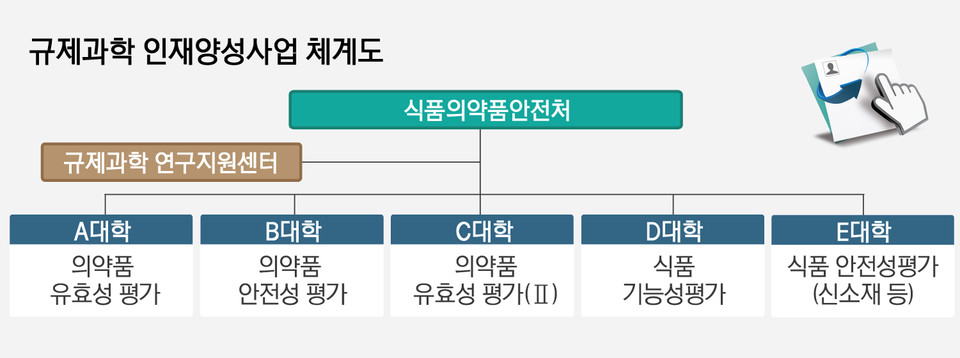
사업기간은 오는 2025년까지 총 5년으로, 기본 3년 지원에 단계평가를 통해 2년 추가 지원하는 방식이다.
사업 지원비는 인재양성대학과 연구지원센터 각각 연간 5억원 총 25억원씩이다(약 150억원).
사업 목표는 의료제품, 식품, 의료기기 인허가 등의 규제에 대한 전반적 지식과 안전성, 유효성, 품질 평가, 안전기술 등의 역량을 갖춘 석·박사급 인재를 양성하기 위함이다.
과제는 △의약품 유효성 평가 △의약품 안전성 평가 △의약품 유효성 평가(Ⅱ) △식품 기능성 평가 △식품 안전성 평가(신소재 등) 5개로 나뉘며, 각각 전문가 120명씩 총 600명 이상을 배출할 계획이다.
식약처 관계자는 "산·학·연·관의 협력을 통해 의약품, 의료기기, 기능성 식품 등 규제과학 분야 신산업을 견인할 핵심 인재를 육성하고 규제과학 인재양성사업의 총괄 기획·운영 등 체계적인 기반을 구축할 것"이라고 전했다.
관련 업계는 기대 반 우려 반의 시선으로 이번 인재양성 사업을 바라보는 모양새다.
제약사 C관계자는 "석·박사급 규제과학 전문 인력을 양성하겠다는 정부의 취지에 적극 공감하고 지지한다"며 "한편으론 예산만 투입되고 전문가다운 진짜 전문가를 길러내지 못하는 것은 아닐까 하는 우려도 있다"고 말했다.
이어 "규제과학을 적절히 교육할 수 있는 커리큘럼을 만드는 게 쉬운 일이 아니다"며 "부족한 것은 RA 전문 인력뿐만이 아니다. 이 전문 인력을 교육하는 인력과 시스템도 부족한 것이 문제인데, 실제 현장에 투입될 인재가 배출되기까지 많은 시간이 소요될 것"이라고 덧붙였다.
