국내 바이오의약품 파이프라인 단연 선두...2017년 의미있는 한 해될 것


◆국내 바이오의약품 성공 가능성은?
바이오의약품은 사람이나 다른 생물체에서 유래하는 세포, 단백질, 유전자 등을 원료로 제조한 의약품으로 성분에 따라 생물학적제제, 단백질의약품, 항체의약품, 세포치료제 및 유전자 치료제 등으로 나뉜다.
합성의약품 대비 분자량이 크고 구조가 복잡해 까다로운 생물공정을 거치기 때문에 상대적으로 가격이 높게 형성돼 있지만 약효가 뛰어나고 부작용이 적다는 장점을 가지고 있다.
업계에 따르면 바이오의약품 평균 생산 원가 구조가 생산 35%, R&D 30%, 마케팅 35%를 차지한다.
생산부터 따져보면, 우리나라는 이미 세계적 수준에 오른 생산능력을 가지고 있다. 삼성바이오로직스, 셀트리온 등 대규모 생산이 가능한 업체들이 존재하기 때문이다.
실제 삼성은 인천 송도에 연간 18만ℓ규모를 생산할 수 있는 1·2공장을 운영 중인 데다 8500억원을 투입해 짓고 있는 연간 18만ℓ규모의 3공장을 2018년 4분기 가동해 연간 생산량은 36만ℓ로 늘릴 계획이다.
셀트리온은 올해 초 3000억원이 넘는 금액을 투입해 1공장의 증설과 3공장의 신설 등 총 17만리터 공장 증설을 결정했다. 증설이 완료되면 셀트리온의 생산 규모는 현재 14만ℓ에서 31만ℓ로 늘어난다. 이들은 대규모 공장 시설을 통해 제조 단가를 낮춰 가격경쟁력까지 확보했다.
풍부한 인적자원 및 활발한 투자로 R&D 여건도 좋은 편이다. 매년 5만명에 이르는 생명공학 전공자들이 배출되고 있으며 바이오 분야 공공 R&D투자 규모도 연간 4조원이 넘어선다. 뿐만 아니라 수준급 의료진, 선진화된 의료체계, 대형병원 밀집 등으로 서울은 세계 1위 임상도시로 명성을 떨치고 있다.
마케팅 시장은 글로벌 제약사 위주로 고착화 돼 있어 불리하긴 하지만 기술수출 방법을 활용한다면, 생산과 R&D만으로도 국내 바이오 산업의 잠재력은 충분하다는 평가다.
◆국내 바이오의약품은 600억달러 '바이오시밀러'에 집중
성공 가능성은 희망적이다. 그렇다면 국내 바이오시장은 현주소는 어떠할까?
세포치료제는 국내 17개사가 20품목, 90여건 이상의 임상을 진행 중이며 SK케미칼의 세포배양4가백신 개발 등 백신분야도 성과를 보이고 있다. 대부분 초기 임상단계지만 9개 항체신약이 개발 중에 있으며 39품목의 유전자치료제도 임상 단계에 있다.
그러나 국내 바이오의약품은 바이오시밀러에 집중하는 모습이다. 이는 주요 블럭버스터 바이오의약품이 2015년을 기점으로 특허만료가 시작되며 향후 5년 내 대부분의 특허가 만료됨에 따라 이 시장을 공략하기 위한 전략을 세웠기 때문으로 풀이된다.
주요 품목인 '휴미라'는 올해 미국특허가, 2018년 유럽에서 특허가 만료되며 '레미케이드'는 지난해 유럽에서 이미 특허가 만료됐고 미국 특허는 2018년에 종료된다.
'엔브렐'의 미국특허는 2029년으로 멀었지만 유럽특허는 이미 2014년 만료됐으며 '란투스'의 오리지네이터 독점기간도 2015년으로 막을 내렸다.
지난 2013년 유럽에서 특허기간이 만료된 '리툭산'은 미국에서의 특허 보장기간이 2년 남았으며, '아바스틴'(유럽 2022년/미국 2019년)은 그나마 보장기간이 긴 편이다. '허셉틴'은 2014년 유럽시장에서 독점권이 풀렸으며 미국시장은 2019년 만료된다.
작년 기준으로 이들 품목의 매출을 합산하면 600억달러(약 68조원)로 이 시장을 선점하기 위한 승부가 시작된 셈이다.
식약처가 집계한 자료에 따르면 국내에서는 삼성바이오에피스와 LG생명과학, 바이오씨앤디가 휴미라 바이오시밀러 개발을 위한 임상을 진행 중이다.
레미케이드 바이오시밀러는 슈넬생명과학이 노리고 있으며, 엔브렐은 LG생명과학과 대웅제약이 임상 승인을 받았다. 맙테라는 삼성전자가 1상을 진행 중이며 종근당과 씨제이헬스케어는 네스프 바이오시밀러 임상 승인을 받았다. 팬젠은 이프렉스 바이오시밀러 개발에 나섰다.
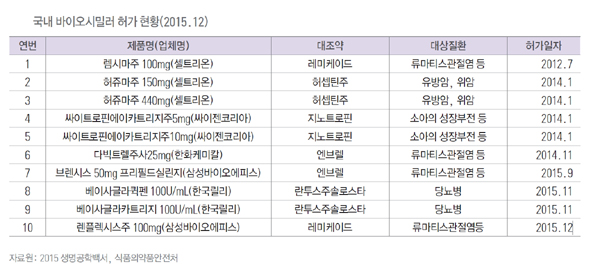
한발 앞서 국내 허가를 획득한 제품들도 있다. 셀트리온은 일찌감치 '렘시마(대조약 레미케이드)'와 '허쥬마(대조약 허셉틴)'의 허가를 획득했다. 한화케미칼은 2014년 11월 '다빅트렐주(대조약 엔브렐)' 허가를 받았으며 삼성바이오에피스는 레미케이드 바이오시밀러 '렌플렉시스주'와 엔브렐 바이오시밀러 '브렌시스'의 허가를 지난해 획득했다.
◆빅파마도 바이오시밀러 군침...휴미라 등 대형약물에 41개 바이오시밀러 개발 중
글로벌 바이오의약품 시장 성장세를 보면 알 수 있듯이 다국적사들도 매력을 느끼는 분야가 바이오시밀러다. 때문에 바이오시밀러 경쟁은 국내사들 간에 국한되지 않으며, 국내 시장보다는 글로벌을 향하고 있다.
미국 바이오시밀러 승인 현황을 살펴보면, 지난해 뉴포젠에 대한 바이오시밀러 '작시오(업체 산도스)'를 시작으로 레미케이드 바이오시밀러 '램시마(셀트리온)', 엔브렐 바이오시밀러 '에렐지(산도스)', 휴미라 바이오시밀러 '암제비타(암젠)' 등이 승인됐다.
유럽에서는 램시마가 2013년 허가를 획득했고, 삼성바이오에피스의 '플릭사비(인플릭시맙)', '베네팔리(에타너셉트)'각 가 올해 5월과 1월에 허가를 받았다. 또한 작년 말 기준으로 엔브렐, 레미케이드, 휴미라, 맙테라 등 4개 오리지널 약물에 대한 41개 바이오시밀러가 개발되고 있는 것으로 나타났다.
이와 함께 다국적사들은 바이오벤처 인수합병이나 전략적 제휴로 기술을 흡수하는 측면돌파 전략도 구사하고 있다.
화이자가 바이오시밀러 개발사인 호스피라를 인수하고 2018년 완공을 목표로 중국 바이오의약품 공장 설립계획을 발표했다. 화이자는 또 셀트리온과 판매계약을 체결해 올해 말부터 램시마의 미국유통을 담당하게 됐다.
노보노디스크는 자사 최대 규모 인슐린 공장 증축을 통해 바이오의약품 생산시설을 확충한다는 계획이며, 젠자임을 인수한 사노피도 벨기에 헤일시의 젠자임 바이오의약품 생산 공장 증설 계획을 밝혔다.
블룸버그에 따르면 특허만료로 2015년 1245억원의 매출을 올린 오리지널 제품 47개의 매출 하락이 머지 않았다는 예상이다. 글로벌 제네릭 기업뿐만 아니라 화이자, 사노피, 베링거인겔하임 등 오리지널을 보유한 제약사들이 바이오시밀러 개발에 적극적인 이유가 이와 무관하지 않아 보인다.
◆국내 바이오시밀러 향후 전망은
바이오시밀러의 성공적인 안착을 위해 필요한 것은 '스피드'와 '데이터'다. 개발 기간과 데이터 축적을 위해 소요되는 10여년의 기간을 감안하면 국내 바이오시밀러 파이프 라인은 단연 선두에 있다.
셀트리온의 램시마는 미국과 유럽에서 가장 먼저 승인된 바이오시밀러다. 또 현재 미국에서 심사 중인 바이오시밀러 6개 중 2개가 삼성바이오에피스 제품이며, 유럽에서 심사 중인 12개 중 5개가 셀트리온과 삼성의 파이프라인이다. 후속주자들이 바짝 쫓아오고 있지만 글로벌 제약사와 경쟁에서 뒤쳐지지 않고 있다.
아울러 의료진의 가장 큰 관심 포인트는 오리지널에서 바이오시밀러로의 대체연구다. 임상과 실제 처방 데이터를 통해 전환 이후 안전성을 입증할 경우 신규 환자뿐만 아니라 기존 환자들의 시장도 잠식할 수 있다는 뜻이다. 빠른 시장 진출은 그만큼 데이터 축적에도 도움이 될 것으로 보인다.
업계 관계자는 "셀트리온의 램시마는 이미 누적매출 1조원을 돌파했지만 추가 허가를 기다리는 약물이 더해지고, 삼성바이오에피스까지 가세하면 국내 바이오시밀러 영향력이 더 커질 것"이라며 "2017년은 국내 바이오의약품이 글로벌 시장에 의미있는 첫 발을 내딛는 해가 될 것"이라고 예상했다.
