코로나19 치료제·백신 국내 승인 임상시험 총 26건
식약처, 허가전담심사팀 구성해 사전심사 진행 체계 마련
아스트라제네카 백신 비임상 시험자료 사전검토 시작
[메디칼업저버 정윤식 기자] 식품의약품안전처가 국내 승인 코로나19(COVID-19) 치료제와 백신 임상시험 현황을 발표한 가운데, 아스트라제네카가 개발 중인 백신에 허가전담심사팀이 구성된 것으로 확인됐다.
특히, 이 허가전담심사팀은 비임상 시험자료에 대한 검토도 시작한 상태다.
식약처는 27일 국내에서 개발되고 있는 코로나19 치료제와 백신의 임상시험 및 허가·심사 현황에 대한 정보를 제공하며 이같이 밝혔다.
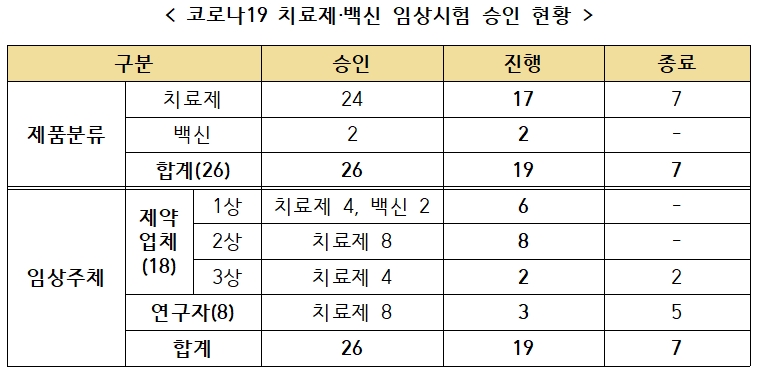
식약처에 따르면 현재 국내에서 승인한 임상시험은 총 26건(치료제 24건, 백신 2건)이다.
이 중 치료제에 대한 임상시험 7건이 종료돼 현재 진행 중인 임상시험은 총 19건(치료제 17건, 백신 2건)이다.
종료된 임상시험 7건은 렘데시비르 3건, 옥시크로린정·칼레트라정, 할록신정, 바리시티닙, 페로딜 각 1건씩이다.
여기서 제약업체가 진행하고 있는 임상시험은 16건이며, 연구자가 진행하고 있는 임상시험은 3건이다.
제약업체가 진행하는 임상시험은 △1상 임상 6건(항체치료제, DNA백신 등) △2상 임상 8건(혈장분획치료제 등) △3상 임상 2건이다.
구체적으로 살펴보면 치료제로는 항바이러스제, 중화항체치료제, 혈장분획치료제, 면역조절제가 개발 중이며 부광약품(레보비르, 항바이러스제), 엔지켐(EC-18, 면역조절제), 신풍제약(피라맥스, 항바이러스제), 대웅제약(DWJ1248, 항바이러스제), 셀트리온(CT-P59, 중화항체치료제), 녹십자(GC5131, 혈장분획치료제) 등이 환자를 모집해 임상시험을 진행하고 있다.
백신은 제넥신(GX-19)이 환자를 모집해 임상시험을 진행 중에 있다.
식약처는 코로나19 치료제와 백신의 신속한 허가를 위해 운영 중인 '고(Go) 신속 프로그램'의 하나로, 허가신청이 예상되는 제품에 대해 신청 예정일로부터 90일 전에 '허가전담심사팀'을 구성하고 사전심사를 진행할 수 있도록 하는 체계를 갖췄다.
특히, 식약처는 현재 아스트라제네카에서 개발 중인 백신에 대해 허가전담심사팀을 구성해 비임상 시험자료에 대한 사전검토를 시작했다.
사실상 식약처 허가전담심사팀이 판단하기에 아스트라제네카가 개발 중인 코로나19 백신이 가장 허가신청이 빠를 것으로 예상되는 제품이라는 의미다.
한편, 식약처는 코로나19 백신의 신속한 임상시험 진입을 위해 지난 6월에 제정한 '코로나19 백신 개발 시 고려사항'을 개정했다.
주요 개정사항은 △3상 임상시험을 위한 자료요건 및 설계방법 △위해성관리계획 수립 등 시판 후 고려사항 △미국 FDA 등 외국 코로나19 백신 지침 추가 등이다.
위해성관리계획(Risk Management Plan)이란, 시판 후 부작용 조사를 위한 의약품 감시방법 및 위해성을 완화하기 위한 조치방법을 계획·실행하는 종합적인 시판 후 안전관리 활동을 말한다.
식약처 관계자는 "코로나19 치료제·백신의 임상시험 등 개발 동향을 지속적으로 모니터링하고 이를 바탕으로 국내 도입을 위해 필요한 품목허가, 특례제조·수입 등에 대한 사항을 지원해 치료 기회를 보장받을 수 있도록 최선을 다하겠다"고 말했다.
