최근 만성콩팥병을 주제로 한 신장학 전문가 좌담회가 개최됐다. 좌장은 김중경 원장(김원묵기념 봉생병원), 김양욱 교수(인제의대 해운대백병원 신장내과)였으며,

고여욱 상무(종근당 효종연구소 바이오연구소장), 박시형 교수(인제의대 해운대백병원 신장내과), 백진혁 교수(계명대학교 동산병원 신장내과)가 차례로 강연 후, 실제 임상례를 바탕으로 토론이 이어졌다. 본지는 이날의 강연 및 토의 내용을 요약 정리했다.
만성콩팥병 빈혈치료제, 종근당 네스벨®(Darbepoetin alfa)의 제품화 연구

전세계 바이오의약품 시장 및 종류
2020년도 전세계 바이오의약품 시장의 규모는 약 340조 정도이다. 2010년 대비 약 2배 성장했으며, 향후 5~6년 뒤에는 500조 이상의 지속 성장이 예측된다. 바이오의약품은 인슐린 및 성장호르몬과 같은 유전자재조합 단백질의약품, 항체의약품, 백신, 유전자 및 세포 치료제로 분류된다.
바이오의약품은 단백질의약품으로 분류되는데 합성의약품에 비해 분자량이 크고 구조가 복잡하고, 세포를 이용한 복잡한 제조 공정이 요구되기 때문에 고가의 개발 비용이 소요된다. 또한 주사제로 투여되기 때문에 경구약과 달리 원료와 완제품의 오염도 및 순도를 철저하게 관리하기 위한 엄격한 규제사항이 적용된다.
단백질의약품은 합성의약품과는 달리 생체유래 물질로서 상대적으로 독성이 낮고, 당뇨병 및 류마티스 관절염 등 합성의약품으로 치료가 어려운 영역의 중증 난치성 만성질환에 우수한 약효를 나타내는 장점이 있다.
1982~1991년에 걸쳐 개발된 1세대 블록버스터 바이오의약품에는 인슐린, 인성장호르몬, EPO, interferon-alpha 등이 있다. 2001~2007년에는 기존 단백질의약품의 반감기를 늘린 바이오베터가 개발되기 시작했다. Darbepoietin-alpha의 바이오시밀러인 CKD-11101(네스벨®)은 2008년부터 약 10년간의 연구를 통해 개발됐으며, 글로벌 기준의 품질을 지닌 최초의 2세대 EPO 바이오베터의 바이오시밀러 품목이다.
바이오의약품 연구개발 프로세스(플랫폼 제조기술)
바이오의약품의 개발은 후보물질 발굴 단계, 생산공정 및 비임상 개발 단계, 임상연구 및 제품 제조 단계 순으로 진행된다.
단백질의약품을 생산하는 4가지 핵심 기술은 1) 유전자 재조합 기술 및 CHO(중국산햄스터난소세포) 생산세포주 제조 기술, 2) 동물세포 및 대장균 배양 기술, 3) 단백질의약품 분리 정제 기술, 4) 단백질 구조 규명 및 품질 분석 기술로 구성된다.
이렇게 생산된 단백질의약품에는 약력학, 약동학, 효능 및 독성 분석을 위한 비임상 동물 실험이 수행된다. 바이오시밀러는 상기 원료 제조 기술을 확보 후, 임상을 거쳐 최종 제품화되기까지 약 8년~12년의 기간이 소요되며, 국내 기준으로는 최소 250~300억 정도의 연구비가 투자되어야 한다.
또한 미국 및 유럽 기준으로 개발부터 임상3상연구까지 약 2천억 정도가 소모된다. 즉 바이오의약품 개발은 막대한 시간과 비용을 수반하는 상당한 노력을 요하는 분야라고 할 수 있겠다.
만성콩팥병 빈혈치료제, 종근당 네스벨® 제품화 연구
종근당 네스벨®은 환자의 관점에서 볼 때, 삶의 질을 개선했고 지속형 제제로서 투여 편의성을 개선했다. 국가 관점에서는 고가의 수입 약제를 국산화하여 약가를 낮춰 국가보험 재정 부담을 경감시키는 데에 기여했다. 또한 네스벨®은 종근당 최초의 바이오품목으로서 국내뿐만 아니라 해외로도 수출되어 국내 바이오 산업을 육성할 수 있는 초석이 되었다.
네스벨®는 darbepoetin alpha 재조합 당단백질로 1세대 EPO 대비 2개의 N-당사슬을 추가로 포함하고 있다. N-당사슬의 추가는 시알산의 함유량을 늘려 반감기를 8시간에서 25시간으로 연장시킨다. 그 결과 1세대 EPO 약제가 주 3회 투여해야 했다면 네스벨®은 주 1회 투여 형태로 개발되어 투여 편의성을 높였다.
임상 3상에서 투석 전 환자를 대상으로 수행한 연구 결과, 오리지널 약제와 동등한 효능을 보였으며, 2018년 국내 허가승인을 받았다. 또한 2020년도 대만, 베트남, 태국을 시작으로 중동 6개국에도 약제 수출을 위한 해외사와의 계약이 체결되었다.
요컨대 종근당은 GMP 생산 시설을 적기에 확보하고 선제적 투자를 감행하여, 오리지널 제품 네스프®와 동등한 수준의 단백질 구조, 품질, 활성, 약효, 안전성을 갖춘 최초의 2세대 EPO 바이오시밀러인 네스벨® 개발에 성공했다.
만성콩팥병 환자에서 적혈구생성자극제의 치료 현황

만성콩팥병(chronic kidney disease, CKD)이 진행될수록 빈혈의 유병률은 증가한다. CKD 환자에서 빈혈은 무력감, 운동능력 저하, 삶의 질 저하를 야기하고, 신사구체여과율을 감소시킬 수 있다. 따라서 CKD 환자에서 적절한 빈혈 관리는 상당히 중요하다. CKD 환자에서 빈혈이 발생하는 기전은 EPO의 절대적 및 상대적 결핍과 헵시딘(hepcidin) 또는 염증성사이토카인 등 요독증 유발 환경으로부터 비롯된 부적절한 적혈구 생성, 철분 부족 등이 있다.
암젠사가 개발한 최초의 EPO제제인 epoetin alpha는 1989년부터 전세계적으로 사용되기 시작했다. 그 이후 darbepoetin alpha가 개발되었고, 현재 3세대 EPO인 methoxy polyethylene glycol epoetin beta까지 개발된 상태이다.
ESA의 안전성에 대해 살펴보면, 1998~2004년에 epoetin alpha (Eprex®)에서 안정제로 사용한 사람혈청알부민 polysorbate 80 formulation과 주사기 고무 마개 간 반응으로 인해 순수적혈구무형성(pure red cell aplasia, PRCA)의 발생이 보고됐었다. 이로 인해 고무를 교체하고 콜드체인시스템을 이용하여 이러한 문제를 해결했다. Normal Hematocrit Cardiac Trial (NHCT) 연구는 EPO 투여 후 혈전증, 심부전 및 심장발작의 증가를 보고했고, Correction of Hemoglobin and Outcome in Renal insufficiency (CHOIR) 및 Cardiovascular Risk Reduction by Early Anemia Treatment with Epoetin Beta (CREATE) 연구는 적혈구생성자극제(erythropoietin stimulating factor, ESA)의 투여로 헤모글로빈이과하게 교정되는 경우, 심혈관 사건의 발생위험이 증가한다는 것을 발견했다. 이러한 연구들을 바탕으로 현재의 헤모글로빈 목표 수치가 설정되었다.
2014년 Emilee 연구팀의 메타 분석 연구에 따르면 darbepoetin alpha와 epoetin alpha 간 사망률의 차이는 없었다. 2018년 일본에서 darbepoetin alpha를 투여 받은 투석을 시행 받지 않은 CKD 환자들을 대상으로 한 3년간의 시판 후 조사 결과에서 주요 심혈관 사건은 1.5%였으며, 헤모글로빈 수치가 10~10.6 g/dL 로 유지되어 darbepoetin의 장기적인 안전성과 유효성이 입증됐다. 또한 2021년 Kidney International Reports에 게재된 Angelo 연구팀의 논문은 미국, 유럽, 일본 등 다국가의 데이터를 종합한 결과, long acting 제제와 short acting 제제간 ESA에 의한 사망률에 유의한 차이가 없다고 보고했다.
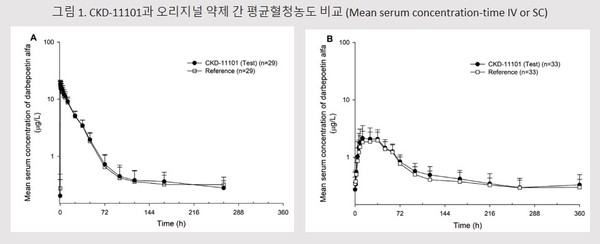
국내 건강한 피험자 108명을 대상으로 CKD-11101 (네스벨®) 60 μg을 정맥 또는 피하주사로 단 회 투여한 결과, CKD-11101은 오리지널 약제와 유사한 약력학 및 약동학적 특성과 내약성을 나타냈다<그림 1>. 또한 면역원성 탐색에서 약제 투약 후 PRCA의 발생과 관련이 있을 것으로 짐작되는 항체 생성이 관찰되지 않았다.
2019년 국내 16개 센터에서 투석을 시행 받지 않은 CKD 환자 248명을 대상으로 진행한 연구에서 CKD-11101은 헤모글로빈 목표 수치(10~12 g/dL)에 도달한 환자 비율, 도달 소요 시간 및 필요 용량에 대해 오리지널 약제와 거의 동등한 효과를 나타냈으며, 이상반응 발생률 또한 유사함을 입증했다.
이어서 국내 24개 센터에서 혈액투석 환자 403명을 대상으로 진행한 임상 연구에서도 CKD-11101는 헤모글로빈 목표 수치 도달비율, 평균 헤모글로빈 수치 및 이상반응 발생률에 대해 오리지널 약제와 유사한 결과를 나타냈다.
요컨대 CKD-11101는 CKD 환자에서 오리지널 약제와 동등한 빈혈 치료 효과를 나타내며, 목표 헤모글로빈 수치를 유지함과 동시에 좁은 헤모글로빈 변동폭을 보이는 효과적인 치료제로 볼 수있다.
안전성 측면에서도 CKD-11101는 기존 ESA 제제와 유사한 이상반응 발현 양상을 보였다. 종합하면 CKD-11101은 오리지널 약제 대비 경제적 이득을 지닌 darbepoetin alpha 바이오시밀러로서 CKD 환자에서 빈혈을 효과적으로 조절하고 안전하게 치료할 수있는 약제다.
만성콩팥병 환자의 진단과 치료 최신 지견

CKD는 콩팥의 기능 및 구조적 손상이 3개월 이상 지속되는 것을 의미한다. 콩팥 손상을 의미하는 지표에는 알부민뇨, 신세관장애로 인한 전해질 이상, 요침사, 조직학 및 영상의학적 이상 등이 있으며, eGFR이 60 mL/min/1.73m2 미만을 나타내는 경우도 CKD에 포함된다.
CKD에서 인 조절은 중요하다. 인간의 하루 평균 인 섭취량은 약 1,200 mg이며, 그 중 약 800 mg은 콩팥을 통해 소변으로 배설되기 때문에 콩팥 기능이 인의 항상성에 미치는 영향은 크다고 볼수 있다. 그렇다면 혈중 인 수치가 체내에 미치는 영향에 대해 살펴보겠다.
Coronary Artery Risk Development In young Adults(CARDIA) 연구는 정상 신기능을 지닌 약 3000명의 건강한 젊은 성인을 대상으로 혈청 인 수치가 증가함에 따라 관상동맥 칼슘 수치가 증가함을 확인했다. 또한 혈액 투석을 받지 않은 CKD 환자를 대상으로 진행된 12건의 코호트 연구를 메타분석한 결과, 혈청인수치의 감소는 신부전 위험 및 총사망률을 낮췄다.
다음으로 혈액투석 환자 25,588명을 대상으로 시행한 Dialysis Outcomes and Practice Patterns Study (DOPPS) 연구는 혈청 인수치가 3.6-5.0 mg/dL으로 유지되는 경우, 심혈관 사건 및 총사망률이 비교적 낮아짐을 확인했다.
CKD 환자에서 고인산혈증을 치료하기 위해서는 신기능 보존, 적절한 투석, 식이요법, 인 결합제의 사용이 필요하다. 먼저 CKD의 식이요법에서 인은 단백질 및 식품 첨가제에 많이 존재하기 때문에 저단백 식이를 권장한다. 단, 과도한 저단백 식이는 영양결핍을 일으킬 수 있으므로 투석 환자의 경우, 하루 1.1~1.4 g/kg의 단백질 섭취가 필요하다. 인 함량이 낮고 단백질은 풍부한 계란흰자, 돼지 껍데기, 양고기, 참치 등은 식이요법에 도움이 되지만, 인 함량이 높고 단백질은 부족한 땅콩, 검은콩, 호두, 계란 노른자, 저지방 우유 등은 피해야 한다.
또한 음식을 30분 정도 끓이면 인이 약 42% 감소하므로 끓여서 먹는 식습관을 추천한다. 또한 무기인보다는 위장관 흡수가 덜한 유기인을 섭취하는 것이 좋다. 고유량(high-flux) 혈액투석은 일주일 기준 약 2,400 mg의 인을 제거하며, 혈액투석여과법은 약 3,500 mg의 인을 제거할 수 있다. 이는 인이 작은 크기의 분자량을 가지나 중간 크기의 분자량을 가진 것처럼 행동하기 때문이며, 매일 투석, 야간 투석, 투석 시간 증가, 투석 표면적 증가가 인 제거에 도움이 된다.
식이요법과 투석 요법에도 불구하고 체내에 누적되는 인을 제거하기 위해서는 인 결합제를 사용할 수 있다. 인 결합제에는 알루미늄계, 칼슘계, 비칼슘계 및 최근 개발된 철(Fe)기반 인결합제 등이 있다. Accelerated Mortality on Renal Replacement(ArMORR) 연구는 혈액 투석을 받은 10,044 명의 환자들을 대상으로 인 결합제와 생존률의 관계에 대해 분석했다. 그 결과, 인 결합제 투여군은 미투여 군 대비 유의한 생존 이득을 보였다.
4,622명의 CKD환자들이 포함된 11건의 무작위 배정 연구를 메타 분석한 결과에 따르면 비칼슘 함유 인결합제는 칼슘 함유 인결합제에 비해 낮은 사망률을 보였으며, 관상동맥 석회화에도 더 큰치료이득을 나타냈다. 특히 칼슘 함유 인결합제는 체내 칼슘 축적이 우려되므로 고칼슘혈증 환자에서는 사용하지 말아야 한다.
2017년 Kidney Disease: Improving Global Outcomes(KDIGO)가 발표한 만성콩팥병-미네랄뼈질환 임상진료 가이드라인에서는 CKD 3a-5D 단계 환자에서 혈중 인 수치를 정상 범위내로 감소시킬 것, 성인 환자의 경우 고칼슘혈증을 피할 것, 인 감소 치료를 받고 있는 성인 환자에서 칼슘계 인결합제의 투여량을 제한할 것, 식이 인 섭취를 제한하고 식이 권고 시 인의 제공원을 고려할 것 등을 권고했다. 요컨데 CKD 환자에서는 인 조절이 중요하며 이를 위해 식이요법, 혈액투석, 인 결합체를 유기적으로 적절하게 활용하는 것이 필요하겠다.
정리ㆍ메디칼라이터부

