지난해 임상시험 승인 건수 전년보다 85건 증가한 799건
초기단계, 항암제, 항생제 분야 두드러져…글로벌 6위

[메디칼업저버 정윤식 기자] 코로나19(COVID-19)도 임상시험 열기를 막지 못했다.
식품의약품안전처와 국가임상시험지원재단의 2020년 임상시험 최근 승인현황을 분석한 결과 지난해 임상시험 전체 승인 건수는 799건으로 나타났다.
이는 코로나19 팬데믹 상황임에도 전년(2019년) 714건 대비 약 11.9%(85건) 증가한 수치다.
임상시험이 3년간 지속적인 증가세를 보였고, 제약사의 초기단계 임상시험이 급증했으며, 항암제 및 감염병치료제(항생제 등) 분야 임상시험이 증가한 것 등이 주요 특징이다.
임상시험 3년간 증가…1·2상 초기단계 시험 비중 커
지난해 임상시험은 799건으로 2019년 대비 11.9%, 2018년(679건) 대비 17.7% 늘어나 최근 3년간 지속 증가했다.
특히 제약사 주도 임상시험이 611건(76.5%)으로 2019년(538건)보다 13.6% 늘어나 전체 임상시험의 증가를 견인한 것으로 집계됐다.
연구자 주도 임상시험은 188건으로 2019년(176건)에 비해 6.8% 많아졌지만, 전체 임상시험에서 차지하는 비중은 23.5%로 전년 24.6%에서 소폭 감소했다.
제약사 임상시험 611건 중 여러 국가에서 동시에 진행한 다국가 임상시험은 355건(58.1%)이다.
이는 2019년(288건) 대비 23.3% 증가한 수치다.
단, 국내 임상시험은 256건(41.9%)으로 2019년(250건)과 유사한 수준을 유지한 것으로 확인됐다.
제약사 주도 임상시험을 단계별로 살펴보면 초기단계(1상·2상)를 중심으로 증가했다.
2019년 대비 1상 임상시험은 25.7%, 2상 임상시험은 21.3% 늘어난 반면 3상 임상시험은 3.8% 감소한 것.
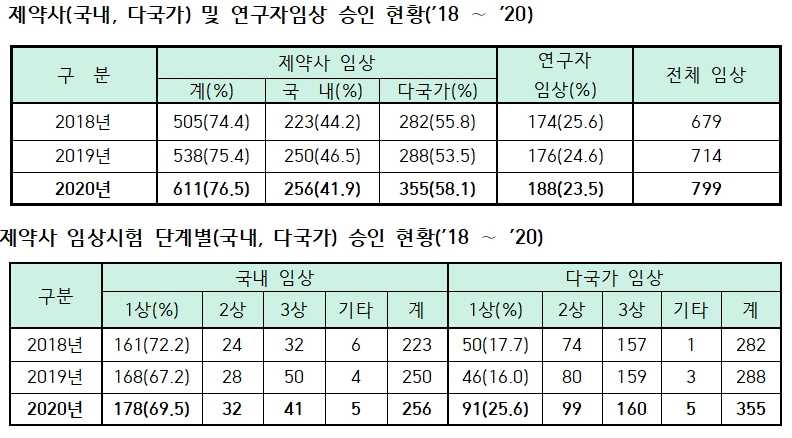
구체적으로 1상 임상시험 승인 건수는 2018년 211건에서 2019년 214건, 2020년 269건으로 꾸준히 증가했고, 2상 임상시험 승인도 98건→108건→131건으로 계속 늘었다.
하지만 3상 임상시험 승인 건수는 2018년 189건에서 2019년 209건으로 늘었지만 2020년에 201건으로 소폭 하락했다.
초기단계 임상시험이 많아진 이유는 항암제와 감염병치료제(항생제 등) 분야의 초기 임상시험이 증가했기 때문으로 분석된다.
항암제는 2019년 대비 1상 122%(45건→100건), 2상 66.7%(36건→60건) 급증했고, 감염병치료제도 2019년 대비 1상 166%(9건→24건), 2상 200%(6건→18건) 증가했다.
특히, 기존 다국가 임상시험은 3상 중심이었으나 지난해 처음으로 다국가 초기 임상시험(1상·2상)이 후기 임상시험(3상)을 앞서는 양상을 보였다.
항암제, 감염병치료제, 내분비계, 소화기계 순
코로나19 치료제 및 백신 임상시험 37건 승인
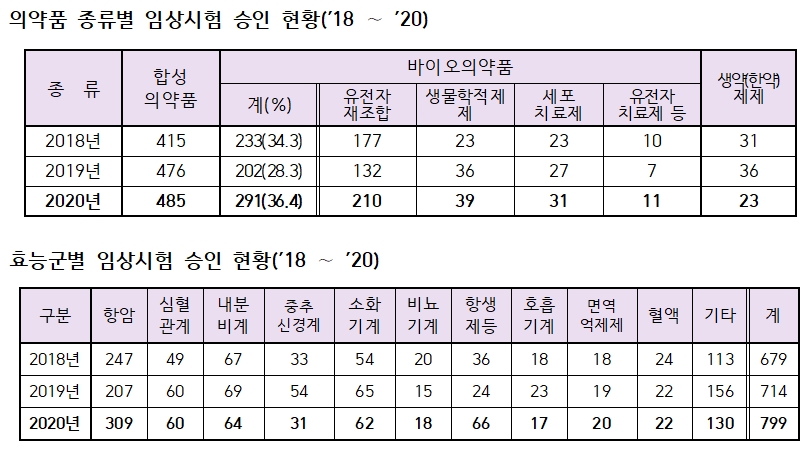
799건의 전체 임상시험을 효능군별로 분류하면 항암제(309건), 감염병치료제(66건), 내분비계(64건), 소화기계(62건), 심혈관계(60건) 등의 순이다.
우선 항암제 임상시험 건수는 309건으로 2019년(207건) 대비 49.3% 늘었고, 전체 임상시험 중 차지하는 비율은 38.7%로 전년 29.0%에서 9.7%p 증가했다.
임상시험 주체별로는 제약사 235건(76.1%), 연구자 74건(23.9%)으로 제약사 비중이 상대적으로 높았다.
이를 단계별로 보면 1상 100건(32.4%), 3상 75건(24.3%), 2상 61건(19.7%) 순으로 나타나 1상 임상시험의 비중이 가장 컸다.
실시국가별로는 다국가 216건(69.9%), 국내 93건(30.1%)으로 다국가 비중이 높게 나타나는 등 항암제 개발을 위한 다국가 임상시험의 조기 진입이 증가해 국내 환자의 치료기회가 확대되고 있는 것으로 나타났다.
이어 작용기전별로 집계하면 △표적항암제 164건(53.1%) △면역항암제 89건(28.8%)△병용요법 등 기타 56건(18.1%) 순으로 확인됐고, 주요 질환으로는 △폐암 48건 △유방암 30건 △림프종 19건 △백혈병 16건 △전립선암 15건 △다발성골수종 10건 △췌장암 10건 △고형암 57건 순이다.
지난해 코로나19 팬데믹 상황으로 코로나19 치료제·백신 임상시험이 37건 승인되는 등 감염병치료제 분야의 임상시험이 증가한 게 가장 큰 특징이며, 주로 국내 제약사 주도로 치료제 개발을 위한 초기 임상시험 단계에 집중한 집계됐다.
종류별로는 △치료제 30건(81.1%) △백신 7건(18.9%)으로 치료제 임상시험이 더 많았으며, 임상시험 주체별로는 △제약사 27건(73.0%) △연구자 10건(27.0%)으로 제약사 비율이 높았다.
단계별로는 1상 임상시험 12건, 2상 임상시험 11건, 3상 임상시험 5건, 연구자 임상시험 9건으로 초기 임상시험 중심이었다.
국내 개발 제약사 임상시험 256건…합성의약품 중심
전체 임상시험 글로벌 순위 8위에서 2단계 상승해 6위
지난해 국내 개발 제약사 임상시험은 256건으로 2019년 230건과 유사한 수준을 유지했으며 당뇨, 고혈압 등 만성질환 치료제 개발을 위한 합성의약품 중심의 국내 1상 임상시험에 집중한 것으로 나타났다.
1상 임상시험(175건) 중 합성의약품은 132건(75.4%)이며 효능군별로 보면 내분비계 34건, 심혈관계 29건, 소화기계 22건 등이다.
이중 신약은 71건(27.7%, 53개 제품)으로 △합성의약품 47건(34개 제품) △바이오의약품 21건(17개 제품) △한약(생약)제제 3건(2개 제품)으로 구분된다.
개발 중인 합성신약(34개 제품)을 질환별로 나누면 항암제 12개, 소화기계 4개, 중추신경계와 근골격계 각 3개, 감염병치료제·내분비계·비뇨기계 각 2개 제품 등이다.
반면 바이오의약품(17개 제품)의 경우 감염병치료제 8개, 항암제 6개 제품 등 코로나19 백신 및 항암제 개발에 집중된 양상이다.
전체 임상시험을 의약품 형태별로 분류하면 합성의약품 485건(60.7%), 바이오의약품 291건(36.4%), 한약(생약)제제 23건(2.9%) 순이다.
합성의약품은 2019년(476건)과 유사한 수준을 유지했지만, 바이오의약품은 2019년(202건) 대비 44.1% 증가했다.
바이오의약품 중 유전자재조합 의약품은 210건으로 2019년(132건)보다 59.1% 늘었고, 그중 항암제 관련 임상시험은 126건으로 전년 74건이 비해 70.3% 증가했다.
국내 제약사별로는 △종근당(22건) △애드파마(17건) △대웅제약(17건) 순이고, 글로벌 제약사별로는 △한국로슈(25건) △한국엠에스디(23건) △한국아스트라제네카(19건) △한국노바티스(17건) 순으로 집계됐다.
임상시험수탁기관(Contract Research Organization, CRO)별로 구분하면 △한국아이큐비아(40건) △아이엔씨리서치사우쓰코리아(21건) △노보텍아시아코리아(20건) 순이며, 연구자 임상시험은 △서울대병원(30건) △삼성서울병원(23건) △세브란스병원(21건) △서울아산병원(20건) 순으로 나열된다.
전 세계 임상시험 승인 통계에 따르면 코로나19 확산에 따른 위축 우려에도 불구하고 전체적으로 임상시험이 증가한 모습이다.
전 세계 신규 등록 제약사 주도 의약품 임상시험 건수는 지난해 5068건으로 2019년(4435건) 대비 14.3% 증가했다(미국 국립보건원 임상시험 온라인 등록시스템 기준).
우리나라도 민·관·연이 적극적인 협력체계를 구축하고 신약개발 역량 강화 및 신속한 임상시험 수행을 위한 제도적 지원 등을 통해 역대 최고 글로벌 순위를 기록했다.
전체 임상시험 글로벌 순위는 6위로 2019년 8위보다 2단계, 다국가 임상시험 글로벌 순위는 10위로 2019년 12위 보다 2단계 상승했다.
특히, 단일국가 임상시험 글로벌 순위는 3위를 유지했다.
이와 관련 국가임상시험지원재단 관계자는 "국내 임상시험의 증가, 다국가 임상시험의 약진은 우리나라가 코로나19로 인한 임상시험 환경변화에 신속하게 대처한 결과로 국내 임상시험 수행역량을 전 세계적으로 인정받고 있기 때문"이라고 말했다.
이어 "항암제 초기 임상시험의 증가는 말기암 등 대체치료수단이 없는 환자에게 새로운 치료 기회를 마련할 수 있을 것으로 기대한다"고 덧붙였다.

