[메디칼업저버 주윤지 기자] 코로나19(COVID-19) 팬데믹을 종식하기 위해 예방 백신을 개발하는데 전 세계 제약사가 임상시험에 뛰어든 가운데 지난 9일 기준 전 세계적으로 개발되는 백신 후보는 180개인 것으로 확인됐다.
세계보건기구(WHO)는 전 세계적으로 개발되고 있는 코로나19 백신 현황을 지난 9일 업데이트했다. WHO에 따르면 백신 후보 180개 중 35개는 임상시험에 돌입했고 145개는 전임상 단계다.

지난달 28일 발표된 WHO 데이터와 비교했을 때 존슨앤드존슨 자회사 얀센은 임상 3상 단계에 새로 진입했고, 노바백스는 2상, 사노피-GSK는 1/2상, 베이징 완타이 바이오파마시-샤먼대학교(Beijing Wantai Biological Pharmacy-Xiamen University)는 1상을 시작한 차이가 있었다.
이에 본지는 임상 3상에 돌입한 주요 코로나19 백신 후보의 임상결과를 종합적으로 설명한다.
주요 코로나19 백신 후보 임상시험·허가 현황은?
지난 9일 기준 임상 3상에 진입한 백신 후보는 총 9개다. 이들은 ▲스웨덴 아스트라제네카-영국 옥스퍼드대학교 ▲중국 칸시노-베이징 이공대학교 ▲러시아 가말레아연구소 ▲중국 시노백 ▲중국 우한생명과학제품연구소-시노팜 ▲베이징생명과학제품연구소-시노팜 ▲미국 모더나-미국국립알레르기전염병연구소(NIAID) ▲미국 화이자-바이오앤테크-포선파마(Fosun Pharma) ▲벨기에 얀센로부터 개발됐다.
이 중 가말레아연구소, 칸시노, 시노백이 각각 개발한 백신들은 임상 3상을 걸치지 않고 승인을 받아 논란을 일으켰다.
이에 서울아산병원 김성한 교수(감염내과)는 지난달 31일 본지와 인터뷰에서 "빨리가 최고 아니다"라면서 "선의의 경쟁으로 조기로 유행을 종식할 필요는 있지만 안전한 백신을 빨리 개발하는 것이 관건이다"고 평가했다.
또 "입증되지 않은 채 백신을 접종하고 부작용이 생기면 코로나19 백신에 대한 불신이 생겨 이후 효과적인 백신이 출시되도 사람들은 접종을 꺼려해 유행이 악화될 가능성이 크다"고 설명했다.
임상 3상 진입한 제약사 8곳의 연구결과는?

개발사: 모더나-미국국립알레르기전염병연구소(NIAID)
백신명: m-RNA-1273
백신 종류: RNA
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 미국 모더나 제약사는 미국국립알레르기전염병연구소(NIAID)와 개발한 m-RNA-1273 백신 후보를 임상 3상 COVE에서 연구하고 있다고 지난 7월 27일 밝혔다. 이번 무작위 대조군 임상 3상은 미국 내에서 18세 이상인 참여자 3만 명을 모집해 진행되고 있다. 연구팀은 mRNA-1273 100 μg이 코로나19 감염을 예방하는 효과를 검토한다.
모더나는 2상 결과를 검토하면서 3상을 시작한 것이다. 지난 7월 8일 모더나는 백신 안전성을 평가하기 위해 진행된 임상 2상에 18~55세인 건강한 성인 300명과 55세 이상인 건강한 성인 300명을 등록했다고 밝혔다.
또 모더나는 지난 7월 14일 임상 1상 연구결과를 의학저널 NEJM(New England Journal of Medicine)에 발표한 바 있다. 1상은 18~55세인 건강한 성인 45명 대상으로 백신의 적합한 용량과 안전성을 검토했다. 모더나에 따르면 mRNA-1273 접종은 Th1-편향 CD4 T세포 반응을 유도했고 전반적으로 안전했다.
모더나는 미국 정부로부터 코로나19 백신을 신속하게 개발할 수 있도록 '오퍼레인션 워프스피드(Operation Warp Speed)' 하에 지원금을 받았으며 2021년 초까지 최소 연간 5억 도즈(dose)를 생산할 예정이라고 밝혔다.

개발사: 가말레아연구소
백신명: 스푸트니크 V(Sputnik V)
백신 종류: 비자가복제 바이러스백터(NRVV)
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 가말레아연구소(Gamaleya Research Institute)는 임상 3상을 진행하지 않은 채 지난 8월 11일 세계 최초로 코로나19 백신인 '스푸트니크 V'을 허가했다. 러시아 정부에 따르면 임상 3상은 현재 참여자를 모집하고 있지 않다.
앞서 러시아 연구진은 스푸티니크에 대한 임상 1상, 2상을 완료했다고 말했고 백신은 강한 항체와 세포 면역반응을 일으켰다고 주장했다. 하지만 러시아 연구팀은 승인 당시 스푸트니크 V에 대한 임상결과를 공개하지 않았다. 지난 4일 임상 1/2상 연구결과는 더랜셋에 발표됐다.

개발사: 칸시노 바이오로직스-베이징이공대학교
백신명: Ad5-nCoV
백신 종류: 비자가복제 바이러스백터(NRVV)
접종 수: 1번
투여 방법: 근육주사
임상시험 현황: 칸시노는 베이징이공대학교(Beijing Institute of Biotechnology)와 개발한 Ad5-nCoV 백신에 대해 임상 1상과 2상을 진행했지만 3상은 시작하지 않았다. 하지만 중국 보건당국은 지난 6월 칸시노에 제한적인 허가를 했다고 로이터통신이 보도했다.
칸시노는 Ad5-nCoV에 대한 임상 3상인 NCT04526990과 NCT04540419에 참여자를 아직 모집하지 않은 것으로 확인됐다.
지난 7월 20일 의학저널 '더랜셋(The Lancet)'에 발표된 임상 2상 결과에 따르면 칸시노 Ad5-nCoV 백신을 한번 접종했을 때 백신은 안전하고 대부분 참여자에서 면역반응을 유도했다. 또 지난 5월 22일 더랜셋에 발표된 칸시노 임상 1상 결과에 따르면, 칸시노 백신은 접종 후 28일 시점에 내약성과 면역원성이 확인됐다. 또 코로나19 감염증에 대한 체액반응은 건강한 성인에서 접종 후 28일 이내 최고조에 달했으며 '빠른 특이적 T-cell(rapid specific T-cell)' 반응은 접종 후 14일부터 기록됐다.

개발사: 시노백
백신명: 코로나백(CoronaVac)
백신 종류: 불활성화(Inactivated)
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 지난 7월 3일 브라질 보건당국은 시노백의 코로나백에 대한 임상 3상을 시작하도록 허가를 내줬다. 이번 3상은 브라질에 거주하는 약 9000명의 의료진을 모집하며 인도네시아와 방글라데시에서도 진행된다.
시노백은 현재 임상 1/2상 결과를 모니터링하고 있는 것으로 알려졌다. 동료평가를 거치지 않은 프리프린트서버 medRxiv에 발표된 임상 2상 결과에 따르면 시노백 백신의 내약성이 확인됐고 도즈 관련 안전성 문제는 관찰되지 않았다. 부작용 대부분은 경증(Grade 3 유해반응 이하)였으며 주사 부위의 통증이 가장 많이 보고됐다. 시노백은 또 낮은 코로나백 용량(3μg)으로 면역원성을 보였다고 밝혔다.

개발사: 시노팜(+우한생명과학제품연구소/베이징생명과학제품연구소)
백신명: 없음
백신 종류: 불활성화(Inactivated)
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 중국 정부가 운영하는 시노팜 제약사는 러시아 가말레아연구소와 중국 칸시노와 같이 임상 3상을 진행하지 않고 중국 보건당국으로부터 허가를 받았고 제한적으로 접종하고 있는 것으로 알려졌다.
시노팜은 우한생명과학제품연구소과 베이징생명과학제품연구소랑 각각 백신 후보를 개발했고 지난 7월 18~60세인 건강한 성인 1만 5000명을 포함한 임상 3상을 아랍에미리트(UAE)에서 시작했다고 밝혔다. 또 페루와 바레인에서도 임상 3상을 진행할 예정이라고 밝혔다.
지난 8월 13일 '자마 네트워크(JAMA Network)' 의학저널을 시노팜의 임상 1상과 2상 결과를 종합적으로 분석한 중국 연구팀의 연구논문을 게재했다. 임상 1상은 건강한 성인 96명 상대로 시노팜 백신의 안전한 용량을 평가했다. 임상 2상은 건강한 성인 224명 상대로 백신을 접종해 안전성과 효과를 평가했다. 중국 연구팀이 1상과 2상 결과를 분석한 결과, 참여자는 불활성화 백신에 대한 부작용 발생률이 낮았고 면역원성을 보였다.

개발사: 화이자-바이오앤테크-포선파마
백신명: BNT162b2
백신 종류: RNA
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 화이자-바이오앤테크-포선파마는 지난 7월 27일 미국, 브라질, 아르헨티나, 독일 등 코로나19 확산이 두드러진 국가에서 건강한 성인 3만 명을 포함한 임상 2/3상을 시작했다고 밝혔다. 이어 지난 12일 화이자는 다양한 인구를 포함하기 위해 참여자를 4만 4000명으로 확대 모집할 수 있도록 미국식품의약국(FDA)에 수정된 프로토콜을 제출했다고 밝혔다.
지난 7월 1일 화이자는 BNT162b1 백신이 임상 1/2상에서 안전성을 확인했으며 접종받은 참여자에서 RBD-binding lgG 항체가 더 많이 확인됐다고 밝혔다. 또 지난 8월 20일 화이자는 임상 1상에서 BNT162b2 30μg 용량을 참여자에게 두 번 접종한 7일 이후 18~55세인 성인에서 바이러스를 중화하는 GMT(geometric mean titers)가 확인됐다고 밝혔다.
아스트라제네카와 마찬가지로 화이자는 미국 정부에서 백신을 개발하는 데 지원금을 받았다. 이에 따라 화이자는 올해 말까지 승인을 신청할 예정이라며 2021년 말까지 13억 도즈를 공급 목표를 잡았다고 밝혔다.

개발사: 아스트라제네카-옥스퍼드대학교
백신명: ChAdOx1 nCoV-19
백신 종류: 비자가복제 바이러스백터(NRVV)
접종 수: 1번
투여 방법: 근육주사
임상시험 현황: 아스트라제네카는 NIAID 지원금으로 지난달 31일 미국 성인 30만 명을 포함해 임상 3상을 시작했다고 밝혔다. 하지만 지난 10일 아스트라제네카는 임상 3상에 참여한 성인 한 명에서 심각한 부작용이 발생했다며 시험을 임시로 중단했다. 복수의 외신에 따르면 이번 부작용은 횡척수염(transverse myelitis)으로 의심된다며 이는 근육 약화, 마비, 통증을 일으킬 수 있는 중증질환이다.
이어 지난 13일 아스트라제네카는 임상 3상을 영국에서 재개했다고 밝혔다. 이번 재개는 영국 보건당국인 MHRA(Medicines Health Regulatory Authority)가 안전성 사건을 검토한 후 진행을 허가해서 가능했다.
지난 7월 20일 아스트라제네카는 임상 1/2상 결과에서 ChAdOx1 nCoV-19 백신에 대한 강한 항체와 T세포 반응을 관찰하고 백신의 안전성을 확인했다며 이와 같은 연구결과를 더랜셋에 발표했다.

개발사: 얀센(존슨앤드존슨)
백신명: Ad26.COV2-S, recombinant
백신 종류: 비자가복제 바이러스백터(NRVV)
접종 수: 2번
투여 방법: 근육주사
임상시험 현황: 얀센은 지난 8월 10일 18세 이상인 건강한 성인 약 6만 명을 등록하는 가장 큰 대규모 임상 3상을 시작하겠다고 밝혔다. 지난 7월 30일 의학저널 '네이처(Nature)'에 발표된 전임상 결과에 따르면 Ad26.COV2-S, recombinant 백신은 강한 면역반응을 유도하고 바이러스 감염으로부터 예방했다.
백신 허가를 위한 임상시험 단계는?
백신은 일반 약물과 달리 질병을 치료하는 것보다 건강한 사람에게서 질병을 예방한다. 그러나 백신과 약물은 유사한 임상시험 단계를 걸친다. 백신 후보는 ①전임상 ②임상 1상 ③임상 2상 ④임상 3상을 포함해 총 네 단계를 통과해 허가를 받는다.
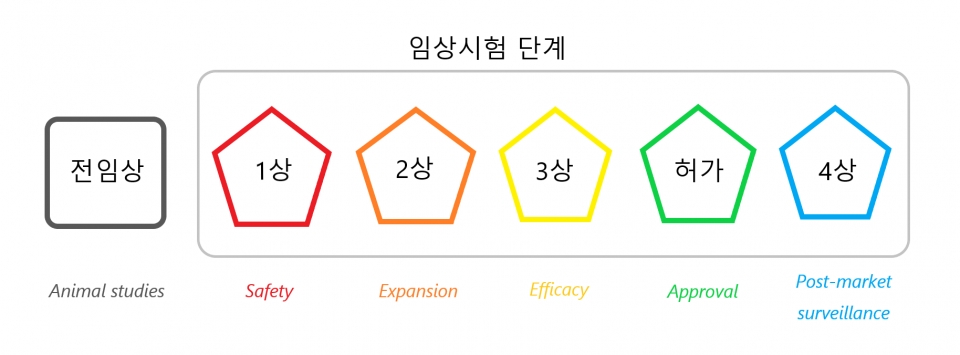
'동물시험' 전임상(preclinical trial)은 조직배양·세포배양과 동물시험을 통해 백신 후보의 안전성과 면역원성·면역반응을 유발하는 효과를 평가한다. 전임상은 주로 생쥐와 원숭이에 진행된다. 대부분의 백신 후보는 전임상 단계에서 면역반응을 생성하지 못해 임상 1상에 진입하지 못한다. 전임상 단계는 평균 1~2년 걸린다.
'안전성'을 평가하는 임상 1상은 개발된 백신의 안전한 용량(dose)을 설정하기 위해 소규모로 사람들에게 접종한다. 임상 1상에서 백신이 면역원성 및 독성 기준을 통과하면 연구를 '확대' 및 연장하는 임상 2상이 시작된다. 임상 2상은 임상시험 참가자 약 300명을 포함하며 참가자를 특성에 따라 분류해 백신의 안전성을 검토한다. 임상 1/2상은 개발을 가속하기 위해 1상과 2상을 합치는 방법이다.
'효능'을 확인하는 임상 3상은 2상에서 성공을 거둔 백신 후보를 3000명에게까지 접종하는 대규모 연구다. 임상 3상은 대규모 무작위 이중맹검 연구로 백신을 접종하는 사람들과 위약을 접종하는 사람들을 비교·분석해 많은 사람에게 백신이 안전한지 검토하고 질병을 예방하는 데 효과적인지 검토한다. 백신 후보가 전임상, 1상, 2상, 3상을 성공적으로 통과하면 보건당국으로부터 허가를 받는다.
관련기사
- 코로나19 백신 최소 5개, 낙태아 세포 사용...아스트라제네카, 얀센도
- 코로나19 백신 개발 현황은?
- 코로나19 재감염 사례→백신 무용지물?..."그렇게 단순하지 않다"
- 코로나19 백신 개발에 韓-美-英-中 속도전 성적은?
- 정부, 코로나19 백신 3000만명분 확보 나선다
- 백신 개발→배포→접종까지..."투명성, 백신 신뢰가 핵심"
- 아스트라제네카 코로나19 백신 임상, 부작용 발생 잠재적 이유는?
- 비(非)코로나19 임상시험 위기의 시대
- 강기윤 "식약처, 렘데시비르 부작용 알고도 조건부 허가"
- 코로나19에 약한 고령자, 백신 임상시험에서 제외될 가능성 높아
- 존슨앤드존슨, 코로나19 백신 임상 3상 '불분명 질환' 발생로 임시중단
- 메디카고 "코로나19 백신 승인 시 캐나다 7600만 도즈 공급 예정"
- 백신 임상시험에서 가장 중요한 요소는
- 제롬김 "코로나19 백신 개발만으론 불충분...예방접종 정책 준비해야"

