기존 뇌질환 치료제의 한계 극복한 새로운 가역적
Mao-B Inhibitor 뇌질환 치료 약물 개발
희귀질환·난치성 중추신경계질환의
실패 원인과 신규 치료기전 규명
뉴로바이오젠과 키스트 공동연구진은 알츠하이머성 치매환자의 뇌에서 흔하게 발견되는 반응성 성상교세포(Astrocyte)가 억제성 신경전달물질인 가바(GABA)를 생성·분비함으로써 기억력 및 인지장애가 발생한다는 원인기전(Nature Medicine, 2014)을 바탕으로 치료 효능 및 약물성이 우수한 뇌질환 치료제 후보물질을 개발했다. 더 나아가 이런 작용 기전을 바탕으로 희귀질환인 척수손상을 비롯하여 뇌졸중 후유 장해 및 항비만 치료제로도 비임상을 통해 그 효력을 확인했다.
세계적 학술지 사이언스의 자매지인 'Science Advance'(IF: 12.8, JCR 분야 상위 4.7%) 최신호에 게재된 연구결과에 의하면 치매 쥐에서 초기 1주일 동안은 기존 약물이 가바 과생성에 중요한 마오비(MAO-B, monoamine oxidase B) 효소를 억제함으로써 가바 과생성이 효과적으로 저해할 수 있음을 확인했다.
그러나 장기간 투여 시, 약물에 의해 완전히 저해된 마오비 효소의 역할을 대신할 수 있는 다오(DAO, diamine oxidase) 효소가 과발현되면서 다시 가바가 과생성 되고, 이러한 생체 내 대체기전으로 인해 인지기능 개선 효능이 사라진다는 것을 검증했다. 이러한 문제를 바탕으로 KIST, IBS 연구단은 수년간에 걸쳐 개발에 착수해, 마침내 신규기전에 작용하는 신물질을 개발했다.
뉴로바이오젠이 개발 중인 후보약물은 장기간 투여 시에도 이러한 대체기전을 작동시키지 않음으로써 장기간 동안 지속적으로 인지기능을 개선시키는 매커니즘을 확인했다. 또한 알츠하이머병에 걸린 유전자 변이 실험용 쥐에 해당 물질을 투여해 다양한 행동실험을 통해 인지기능이 회복된 것을 확인했을 뿐 아니라, 적은 용량으로 장기간 투여한 시험에서도 월등한 인지기능 개선 효능을 확인했다.
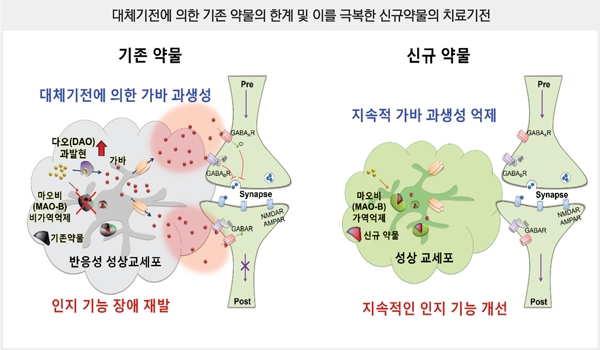
본 약물은 고령의 환자에게 장기간 투여하는 뇌질환(치매, 알츠하이머)약물의 필수 요건인 약물 안전성을 충족하기 위해 생체 유래 화합물인 아미노산구조에 다양한 기능기를 도입함으로써 우수한 안전성을 갖는 화합물로서 다양한 약물성(ADME/Tox)을 검증한 결과 후보약물은 경구로 섭취해도 인체의 뇌 속으로 매우 높은 효율로 전달되었으며, 생체 독성 및 다른 신경계에 부작용이 없는 뛰어난 안전성이 있는 물질로 확인됐다. 이 실험결과를 토대로 GABA 과생성에 기인한 알츠하이머병 외에도 뇌졸중, 척수손상, 비만으로의 적응증 확대가 가능하다.
알츠하이머성치매
알츠하이머병은 주로 노인들에게서 나타나는 점진적이고 치명적인 퇴행성 뇌질환으로, 병리조직학적으로 뇌의 전반적인 위축, 뇌실의 확장, 신경섬유의 다발성 병변(neurofibrillary tangle, NFT)과 초로성 반점 (neuritic plague)등의 특징을 보이며 기억, 판단, 언어 능력 등의 지적인 기능의 감퇴, 일상생활 능력, 인격, 행동 장애 등의 임상적인 특징을 나타낸다. 뿐만 아니라 우울증, 인격의 황폐, 격한 행동 등과 같은 정신의학적인 증세 등을 동반하기도 하며, 이러한 증세들은 점진적으로 진행돼 결국 죽음에 이르게 된다.
알츠하이머병의 정확한 발병기전과 원인에 대해서는 정확히 알려져 있지 않으나, 베타 아밀로이드의 과도한 침착, 타우 단백질의 과인산화에 의한 NFT의 생성, 염증 반응, 산화적손상 등에 의한 뇌세포 손상 등이 발병에 영향을 미치는 것으로 알려졌다. 최근 미국의 연구결과에 의하면 알츠하이머 환자 뇌조직에서 베타 아밀로이드, 타우 단백질, 신경세포의 손상 외에 비 신경세포인 성상 교세포(astrocytes)의 비정상적인 형태적 변화와 기능, 수적 증가 등의 관찰이 보고되면서 알츠하이머병의 기전 연구가 촉발되고 있다.
현재의 알츠하이머병 치료제는 일시적인 환자의 인지 능력 향상을 가져오기는 하지만, 증상의 시작 이후에 따르는 5~20년의 생존율에는 변화를 주지 못하고 있다. 따라서, 가장 필요로 되는 알츠하이머병의 미충족 수요는 질병과 관련한 신경퇴화의 진행을 멈추거나 지연 시킴으로써 지속적인 인지기능을 유지하는 것이며 이러한 약물은 궁극적으로는 환자의 삶의 질을 향상시킴은 물론 치료 및 케어를 위한 사회적 고비용을 절감할 수 있을 것이다 따라서 현재의 알츠하이머병의 근원적 치료제로서 최종적인 임상 승인 단계에 도달하기 위해서는 적극적인 DMST (disease modifying/slowing therapy) 약물치료에 적합한 혁신적인 신규 타깃이 필요하다.
알츠하이머병 관련 유망 약물타깃에 대한 연구동향을 살펴보면 기존의 다른 약물 타겟들에 비해 MAO-B가 매우 유망한 약물 타깃임을 알 수 있다. KDS2010의 신규 치료 기전은 알츠하이머병 환자의 반응성 교세포에서 과발현되는 MAO-B를 효과적이고 선택적으로 저해함으로써 비정상적인 GABA 과생성 및 분비를 조절하여 알츠하이머병의 신경 퇴화 및 인지 장애를 근원적으로 개선시킬 수 있다. 이를 통해 β-amyloid pathway와는 다른 새로운 작용 기전을 통해 알츠하이머병 환자들의 인지기능 장애를 근원적으로 치료할 수 있는 치료제 개발이 가능하다.

후보약물은 알츠하이머병에 걸린 유전자 변이 실험용 쥐에 약물 녹인 물을 먹인 후, 모리스 수 미로실험(Morris water maze) 및 수동회피실험(Passive avoidance)을 수행한 결과, 알츠하이머 실험용 쥐의 인지 기능이 정상 수준으로 회복되고, 낮은 용량(1mg/kg)에서도 월등히 향상됨을 확인했다.
특히 임상에서 초기 효능은 우수하지만 장기간 투여 시 치료 효능이 미비하여 실패한 기존 대조약물과의 비교 실험에서, 대조 약물은 2주가 지나면서 인지능력에 중요한 신경세포의 발화능력이 사라지는 반면에, 본 후보 약물은 4주까지 지속적으로 신경세포의 발화능력을 유지시켜 주었다<그림>.

특히 약물로서의 적합성(ADME/Tox)을 검증한 결과 이 신약 후보약물은 인체의 뇌 속으로 매우 높은 효율로 전달되었으며, 다른 신경계에 부작용이 없는 뛰어난 약물성을 나타냈다.
이번 연구결과는 BBB를 통과하며 높은 효율로 뇌에 전달되어 인체 안전성이 뛰어나 장기간 진행되는 치매 치료약물 임상 시험에서 좋은 결과를 얻을 수 있을 것으로 예상되며, 과거 임상에서 단기적 효능을 보였음에도 결국 승인되지 못한 기존 약물의 실패 원인을 규명하였을 뿐만 아니라, 이러한 한계를 극복할 수 있어 주목받고 있다.

뇌졸중
Single-pellet reaching task 및 실린더 테스트를 이용한 운동기능 회복 효과 확인결과, KDS2010 약물 투여와 재활훈련을 병행한 경우, 정교한 운동기능이 거의 정상 수준에 가깝게 회복됐음을 확인했다.
또한 실린더 테스트로 운동기능 회복 효과를 확인한 결과, 설치류 중풍모델의 경우 운동기능이 상당히 손상돼 있는 반면, 약물 투여군 (Stroke+KDS2010)의 경우 대조군에 비해 운동 기능이 유의하게 회복됐음을 확인했다. 약물 투여군(Stroke+KDS2010)의 경우 대조군에 비해 경색 크기가 감소했으며, 특히 약물 투여와 함께 재활훈련을 병행한 실험군 (Stroke+rehab+KDS2010)에서는 내포 내 경색 크기가 현저히 감소하였음을 확인했다.
척수손상
척수 손상 모델에 KDS2010 약물을 투여할 경우, 모델 동물의 척수 조직 회복효과가 촉진됨을 알 수 있었다. 척수손상 약물투여군 (SCI/KDS2010)의 경우 척수손상 약물 비투여군에 비해 통증을 느끼는 역치값이 유의적으로 증가됐음을 확인했고 상기와 같은 결과를 통해 척수 손상 모델에 KDS2010 약물을 투여할 경우, 모델 동물의 통증 정도가 완화됐음을 알 수 있다.
척수손상 약물투여군 (SCI/KDS2010)의 경우 척수손상 약물 비투여군에 비해 척수 조직 넓이, 수초화 구역 넓이가 증가된 것으로 확인됐고 상기와 같은 결과를 통해 척수 손상 모델에 KDS2010 약물을 투여할 경우, 모델 동물의 척수 조직 재생효과가 촉진됨을 알 수 있다.
비만
고지방 식이 비만모델 생쥐의 궁상핵의 반응성 교세포에서 GABA증가 및 KDS2010에 의한 GABA 과생성억제 효능 검증결과, 궁상핵에서 반응성 교세포의 바이오 마커인 GFAP가 현저히 감소했으며, 더불어 GABA의 과생성이 효과적으로 억제됐음을 확인했다.
현재 뉴로바이오젠은 임상시험 진행을 위한 원료 합성과 완제의약품 포뮬레이션을 진행 중에 있으며, 특성상 의약품허가 최적의 조건을 갖추고 있는 물질이다 또한 영장류 약리안전성 시험이 완료되는 내년 상반기에 1상 IND제출을 목표로 삼고 있다. 또한 내년 초에는 척수손상에 대한 미국 FDA에 희귀의약픔 지정을 통한 Fast Track을 이용해 조기에 시장진입을 목표로 개발하고 있다.
해외규제기관의 심사기준에 충족하는 글로벌 수준의 GLP임상기관에 위탁하여 비임상 시험을 완료했기에 글로벌 신약으로서 기존 개발 의약품과 차별화된 치료기전을 바탕으로 글로벌 기술이전을 추진할 예정이다.

