국회, 엘러간의 텍스쳐드 가슴보형물 '바이오셀(Biocell)"에 관한 "안전 확인 시급"
최도자 의원, "11만 7787여 개 유통...대부분 시술돼 회수불가, 식약처 적극적 조치 필요"

[메디칼업저버 주윤지 기자] 희귀암 유발 가능성이 있는 엘러간의 인공유방은 국내에 11만 7787여개가 유통된 것으로 확인되면서 국회가 식품의약품안전처의 적극적인 조치를 촉구했다.
엘러간은 지난달 24일(현지시간) 희귀암 위험을 높일 수 있는 텍스쳐드 가슴보형물인 바이오셀(Biocell)을 전 세계적으로 회수한다고 발표했다. 이번 조치는 미국식품의약국(FDA)의 요청에 따라 즉시 시행됐다. 한편 국내 식약처는 "철수요청에 근거가 부족했다"고 밝혔다.
한국엘러간 측에서는 의사들에게만 안내하고 소비자에게는 아직 공지한 게 없는 것으로 나타났다.
한국엘러간 관계자는 "바이오셀 텍스쳐드 임플란트, 티슈 확정제(tissue expander) 등 크게 2가지 제품이 이번 자진회수에 해당된다"며 "글로벌 엘러간에서 자진회수 방침이 나와서 한국에서도 자진회수 관련해서 의사 선생님들에게 안내문을 드렸다"고 밝혔다.
FDA에 따르면 엘러간의 텍스쳐드 가슴보형물은 '가슴 보형물 이식 후 역형성 대세포 림프종(BIA-ALCL)' 위험이 타사의 제품보다 6배 높은 것으로 나타났다. 지난 6월 6일 시점에서 FDA에 보고된 BIA-ALCL 글로벌 발생률은 573건, BIA-ALCL 관련 사망은 33건이다. 이 중 481건은 엘러간의 가슴보형물과 연관된 것으로 나타났다. BIA-ALCL 관련 사망 33 중, 12명은 BIA-ALCL 진단받을 때 엘러간의 가슴보형물을 가진 것으로 확인됐다.
국회 보건복지위원회 바른미래당 간사인 최도자 의원이 식약처로부터 제출받은 '한국엘러간사의 회수계획서'에 따르면, 회수대상인 거친표면 유방보형물의 전체 수입량은 30개 모델 11만 7787개로 현재 재고로 파악된 3294개를 제외한 11만 4493개가 유통돼 시술된 것으로 나타났다.
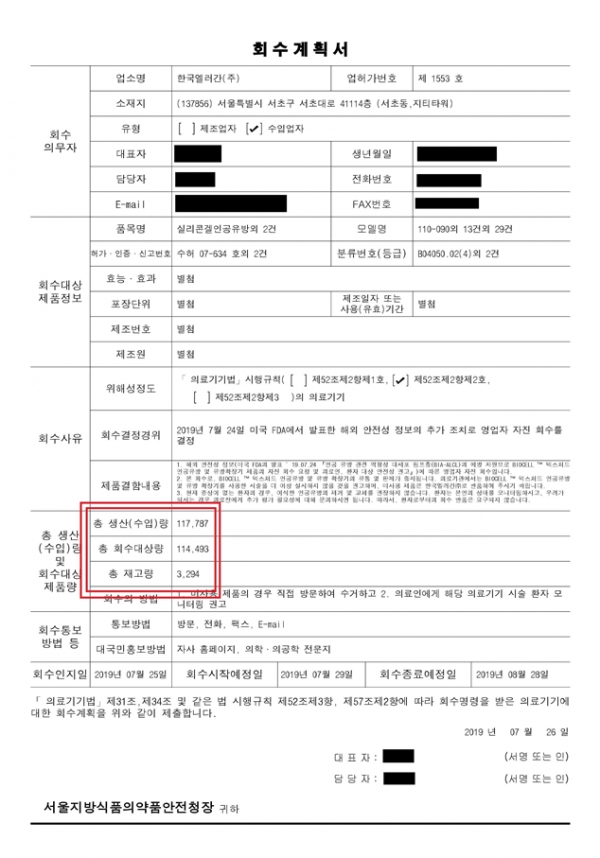
또 국내에 유통된 거친표면 유방보형물은 2007년 처음 허가된 이후, 2018년까지 6개 회사, 총 21만 3000여개로 파악됐다.
하지만 식약처는 "몇 명이 몇 개를 시술받았는지는 파악하기가 어렵다"고 밝혔다.
FDA는 '유방보형물 관련 역형성 대세포 림프종'은 면역체계와 관련된 희귀암으로, 발병확률은 낮지만 일단 발병될 경우에는 치사율이 높다는 점을 강조하면서 가슴보형물 철수를 요청했지만 우리나라 식약처는 "근거 부족"으로 안내와 '경고'만 한 바 있다.
식약처 관계자는 본지와 통화에서 "철수 요청을 할 근거가 명확하지 않아 전문가 또는 의료기기위원회 자문을 통해 조치를 취하고 있다"고 밝혔다.
식약처는 부작용의 중장기 모니터링 하기 위해서 환자등록 연구를 추진 중에 있다고 해명했다. 또 인공유방과 관련된 역형성 대세포 림프종 부작용을 파악하기 위해 사실을 바탕으로 안전관리를 계속 해왔다고 주장했다.
식약처 관계자는 "최근 전문가위원회의 자문을 받고 의료기기위원회 개최했다"며 "문헌 등 해외 조치 상황을 모니터링한걸 종합적으로 판단해서 검토 결과를 바탕으로 안전관리를 강화했다"고 말했다.
하지만 최도자 의원은 "유통량의 대부분이 이미 시술돼 회수하기 어려운 상황"이라며 "유방암 수술 등으로 보형물을 삽입한 사람들이 희귀암에 걸리지는 않을지 불안해하고 있다"고 말했다.
최 의원은 "시술받은 사람의 건강에 이상이 발생할 경우, 검진과 제거수술 등의 비용은 누가 어떻게 책임질지 정해지지 않은 상황"이라 지적하며 "모든 사람들의 안전 확인이 시급한 만큼, 식약처의 적극적인 조치가 필요하다"고 강조했다.
관련기사
- 식약처, 희귀암 유발 '인공유방' 철수 요청 왜 안했나?
- 엘러간, 암 위험 높일 수 있는 가슴보형물 글로벌 리콜
- 인공유방 부작용 조사위해 환자등록 연구 실시
- 엘러간 유방 보형물관련 희귀암 환자 발생
- 엘러간 회수대상 인공유방 부작용 3년간 1389건
- "엘러간 인공유방 판매중지...타사 제품도 검토"
- 식약처, 엘러간 거친표면 인공유방 3개모델 추가 공개
- 인공유방에 의한 희귀암 의심 환자, 검사비 120만원 지원
- 앨러간社 인공유방 림프종 환자 총 3명
- 텍스쳐타입 유방 보형물, 유방암 발생과 관련 있어
- 美FDA, 유방보형물 안전성 경고 강화


그런데 정말 우리 암 환우들을 절망하게 하는 이런 일은 일어나지 않았음 좋겠지만 이미 일은 벌어졌습니다.
지금 이 문제는 쉬쉬 해서 해결된 문제가 아닙니다.
엘러간사나 병원이나 정말 똑같습니다.
문제가 되어 FDA 에서 회수 명령을 받은 이상 안전한 제품이 아님이 밝혀졌음에도 기존 보형물 시술자나 확장기 시술자들에 현재 통증이나 이상증상이 나타나지 않는다 하여 위험하지 않음을 좀 일깨워 주신 거 같이 감사드립니다.
2만명이 넘는 암환우들에게 이런 제품을 사용 했다는건 정말이지 있을 수 없는 일입니다.
현재도 암과 사투를 벌이는 시점에서 희귀암에 걸릴 확률이 6배나 되는 제품을 사용했네요