심평원, 글로벌 혁신신약 평가 규정 개정안 행정예고...12월 31일 시행 예정

[메디칼업저버 이현주 기자] 공표 연기됐던 글로벌 혁신신약 약가우대제도 개정안이 나왔다.
약가 우대를 받기 위해서는 기업과 제품요건을 모두 만족해야 하는데, 기업요건으로는 필수의약품을 수입 및 생산하면서 공급의무 위반이나 리베이트 제공 적발 사례가 없어야 한다.
또한 이들 기업이 결정신청한 약제는 '세계 최초'로 허가된 혁신신약이어야 한다. 기존 혁신형 제약기업 또는 연구개발에 대한 기준은 다 삭제됐다.
건강보험심사평가원은 이 같은 내용을 담은 '약제의 요양급여대상여부 등의 평가 기준 및 절차 등에 관한 규정' 일부개정안을 7일 행정예고했다.
이번 개정안은 지난 한미 FTA 개정협상(이행이슈)에 따른 조치다. 개정 협상 당시 양측 정부는 '글로벌 혁신신약 약가우대제도'를 한미 FTA에 합치하는 방향으로 개정하는데 합의한 바 있다.
올해 안에 시행키로 한 만큼 의견조율을 거쳐 오는 12월 31일 실시될 예정이다.
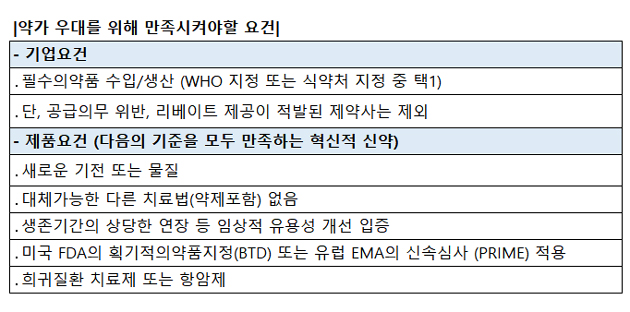
개정안 주요내용을 살펴보면, 기업요건에서 기존 혁신형 제약기업이나 연구개발 투자 요건들이 삭제됐다.
대신 WHO 필수의약품 또는 국가필수의약품 수입·생산 요건이 생겼다.
또한 '공급의무 위반', '리베이트 적발' 등에만 해당되지 않으면 기업요건은 충족하는 것으로 봤다.
품목요건은 기업요건을 충족한 회사가 결정신청한 약제로, 세계 최초로 허가된 혁신적인 신약이어야 한다.
단, 혁신적인 신약에 대한 요건은 △새로운 기전 또는 물질 △대체가능한 다른 치료법이 없는 경우 △임상적 유용성 개선이 입증된 경우 △미국 식품의약국(FDA) 획기적의약품지정 또는 유럽의약품청(EMA) 신속심사 적용 대상 △희귀질환 치료제 또는 항암제 등의 경우를 말한다.
기존 국내에서 전공정 생산하거나 국내-외국 기업간 해당 품목 연구개발 공동계약을 통해 개발된 약 등의 요건은 삭제됐고, 사회적 기여도 항목도 사라졌다.
반면 사후 관리 관련 규정이 신설됐다. 정당한 사유없이 필수의약품 생산 또는 공급을 중단하는 경우 심평원장이 상한금액을 조정할 수 있도록 했다.
또한 신청인은 매년 원장에게 입증자료를 제출토록 했으며, 자료 제출방법 및 시기 등 세부사항은 위원회 심의를 거쳐 원장이 별도로 정하게 했다.
한편 개정안에 대해 의견이 있는 단체 또는 개인은 12월 17일까지 심사평가원 약제관리실(약제등재부)로 의견을 제출할 수 있다.

