글로벌 빅파마, 항생제 개발에 적극...미국, 심사 완화·독점권 부여 ‘밀어주기’
우리나라는 개발 주춤, 신약 도입도 뒤처져...“정책 지원되면 적극 나설 텐데”



카바페넴 내성균의 발현은 한국이 OECD 국가에서도 상위권을 차지하고 있다. 최후의 치료제인 카바페넴으로도 치료되지 않는 다제내성균이 이미 국내 의료기관에 널리 퍼져 있는 상황이라는 뜻이다. 특히 카바페넴에 대한 녹농균 내성률은 OECD 국가 중 2위를 차지할 정도로 심각하다.
정부가 작년 6월 카바페넴 내성 장내세균(CRE)에 대한 전수조사를 시작한 후 현재 1만 건을 돌파했으며(2018년 6월 18일 기준 1만 554건) 2016년 국내에서 보고된 카바페넴 분해효소 생성 장내세균(CPE)은 1455건으로 2015년 565건의 2.5배에 달했다.
FDA 승인 항생제 신약 6개 중 국내 판매는 단 1개
WHO가 최후의 항생제인 '카바페넴계 항생제'에도 내성을 보이는 그람음성 슈퍼박테리아를 최우선으로 해결해야 한다고 공표할 만큼 카바페넴에 대한 효과적인 치료 대안이 요구되지만 우리나라의 항생제 신약 사용은 뒤처지고 있다.
실제 2014년 미국의 항생제 개발 촉진법 시행 이후 FDA에서 승인한 항생제는 달바반신, 테디졸리드, 오리타반신, 세프톨로잔-타조박탐, 세프타지딤-아비박탐, 델라플록사신, 메로페넴-버보박탐 등인데, 국내에서 판매되는 품목은 1개 뿐이다<표 2>.
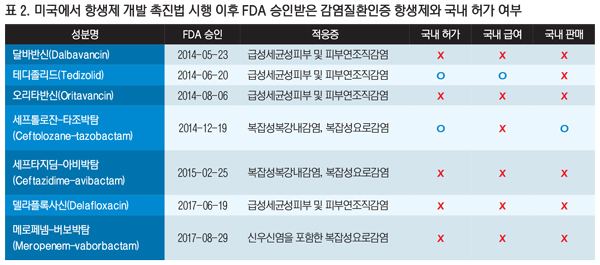
이 중에서는 ESBL(Extended-Spectrum Beta-Lactamase) 생성 장내세균에 효과가 있을 뿐 아니라 카바페넴과 동등성을 입증해 카바페넴을 대체해 사용할 수 있는 치료제도 포함돼 있어 미국과 영국 등은 이미 2~3년 전부터 이를 사용하고 있다.
그러나 우리나라에서는 테디졸리드와 세프톨로잔-타조박탐 단 2개 항생제만 허가를 받았다. 이 중에서도 테디졸리드만 급여를 받았고, 판매되는 제품은 지난달 비급여 출시된 세프톨로잔-타조박탐 뿐이다.
이처럼 국내에 항생제 신약 도입이 어렵고, 허가를 받더라도 판매가 원활하지 않은 이유 중 하나는 낮은 약가 때문이다.
국내에서 새로운 항생제를 급여 출시하기 위해서는 현존하는 대체약제들의 가중 평균가를 받아들이거나 경제성 평가를 통해서 대체 약제 대비 비용 효과성을 입증해야 한다.
하지만 수십 년 전 출시된 모든 계열의 항생제와 제네릭까지 포함해 산출하는 가중평균가는 낮을 수밖에 없다. 또한 현행 경제성 평가는 유효성과 안전성 등의 임상시험 결과 자료를 바탕으로 신약의 가치를 측량하기 때문에 새로운 항생제가 가진 내성 관리 측면의 가치가 반영되기 어렵다.
다국적사 한 관계자는 "비급여로 출시하면 환자 접근성이 떨어지고, 급여등재를 추진하기에는 약가가 너무 낮다"며 "한국에서 건강보험 약가가 낮게 책정될 경우 수익성이 낮은데, 이를 감당하면서 많은 시간과 비용을 투자한 신약을 출시하려는 곳은 드물다"고 말했다.
그는 이어 "다른 국가에서 약가 책정 시 한국 약가를 참조할 수 있어 국내 도입을 꺼리는 경우도 있다"며 "항생제 신약이 임상 현장에서 쓰일 수 있도록 전략과 지원책이 필요하다"고 강조했다.
“국내사 대부분 항생제 파이프라인 없어”
현재 국내에서 개발되거나 개발 진행 중인 항생제는 7개 제품이다. JW중외제약 큐록신과 LG화학 팩티브, 동아ST 시벡스트로, 동화약품 자보란테, 레고캠바이오 LCB01-0371/LCB10-0200, 크리스탈지노믹스 CG400549, 인트론바이오 N-Rephasin SAL200/N-Rephasin NPA200 등이다.
새로운 항생제 도입이 걸음마 수준이지만 개발 상황도 만만치 않다는 것이 국내 제약사들의 목소리다.
동아ST 연구본부 임원빈 실장은 "1970년대 항생제 개발에 정점을 찍은 후 90년대 초만 해도 제약사 대부분이 항생제 신약 파이프라인을 갖고 있거나 제네릭을 개발하고 있었지만 현재 국내 제약 회사 대부분이 항생제 파이프라인이 없다"며 "다만 좋은 항생제 파이프라인이 있다면 라이선스 인 할 수 있다고 생각한다"고 말했다.
임 실장은 새로운 항생제 개발이 주춤하는 이유로 까다로운 개발과정을 꼽았다.
대부분 세포들은 인간 유래세포로, 일반적인 신약 개발 과정 중 후보물질 발견부터 어렵다는 설명이다. 또한 내성균에 감염된 환자에게 임상을 진행해야 하지만 대상군을 모집하는 것도 힘들다. 폐렴 환자를 통해 시벡스트로의 임상을 진행하려 해도 타깃 균을 보유한 환자는 사망 위험이 높아 진행이 원활하지 않았다는 것.
시험약과 대조약을 비교하는 임상시험 방법 역시 항생제 신약 연구에 맞지 않는다는 지적이다.
임 실장은 "사망 위험이 높은 항생제 내성균 감염 환자들에게 대조약을 사용하는 것은 도덕적으로 문제가 된다"면서 "이러한 문제를 외면한 채 항생제 신약을 개발한다는 것 자체가 무모하고 힘든 일"이라고 전했다.
약가 문제가 도입 신약에 국한되는 것만은 아니다. 국내에서 낮은 약가를 받은 항생제 국산 신약이 해외 수출 시 높은 약가를 받기는 힘들다. 우리나라 약가를 참조하기 때문인데, 결국 앞서 언급된 오래된 항생제들의 가중평균가 또는 경제성 평가 문제가 적용된다.
임 실장은 "개발과정의 애로사항과 정책적 지원 등이 해결되면 모든 제약사가 항생제 개발에 뛰어들 것이다. 하지만 지금까지 개발된 항생제들은 투자 비용에 비해 얻게되는 이익이 제로에 가깝다는 통계가 나온다"며 "때문에 항암제 또는 중추신경계 분야에 몰릴 수밖에 없다"고 지적했다.

